
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон действия масс
|
|
|
|
В 1884 г. норвежские ученые К. Гульдберг и П. Вааге открыли ЗДМ, который применим к обратимым химическим процессам, протекающим в 2-х взаимообратных направлениях: Скорость химической реакции промопропорциональна молярным концентрациям веществ. Например,
 nA + mB pC + qD
nA + mB pC + qD
Скорость прямой реакции v1 пропорциональна концентрациям веществ, вступающих в реакцию: v1= k1 [A] [B];
k1 – константа скорости прямой реакции.
Аналогично для обратной реакции: v2= k2 [C] [D]. В течение времени скорость прямой и обратной реакции изменяются и в определенный момент они равны. Этот момент называется химическим равновесием, для него справедливо равенство:
 k1 [A] [B] = k2 [C] [D]
k1 [A] [B] = k2 [C] [D] 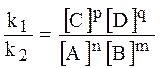 = Kравн.
= Kравн.
Следствие из ЗДМ: При установившемся химическом равновесии отношение произведения концентраций продуктов реакции к произведению концентраций веществ, вступающих в реакцию, в степенях их стехеометрических коэффициентов, при постоянной температуре величина постоянная и называется константой равновесия.
Кравн не зависит от концентрации веществ, но зависит от их природы, температуры и природы растворителя.
Химическое равновесие является динамическим, поэтому смещается по правилу Ле Шателье. Добавление одного из реагирующих веществ вызывает смещение равновесия, продолжающееся до того момента, когда концентрации всех веществ не будут удовлетворять ЗДМ.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 382; Нарушение авторских прав?; Мы поможем в написании вашей работы!