
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энтропия. Рассмотрим, как математически формулируется второе начало термодинамики
|
|
|
|
Рассмотрим, как математически формулируется второе начало термодинамики.
Для обратимого цикла Карно:
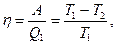 откуда
откуда 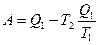
Эта формула определяет максимальную работу, получаемую при превращении тепла в работу. Часть тепла, равная 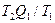 , при этом не может быть превращена в работу, она передается окружающим телам. Отношение
, при этом не может быть превращена в работу, она передается окружающим телам. Отношение 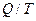 как раз и характеризует ту часть тепла, которую нельзя превратить в работу. Это отношение является мерой неиспользованного тепла. Р. Э. Клаузис назвал эту величину энтропией
как раз и характеризует ту часть тепла, которую нельзя превратить в работу. Это отношение является мерой неиспользованного тепла. Р. Э. Клаузис назвал эту величину энтропией 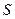 (от греч. превращение).
(от греч. превращение).
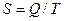 (10.7)
(10.7)
Энтропия является как и внутренняя энергия 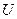 функцией состояния и может быть выражена через параметры состояния системы
функцией состояния и может быть выражена через параметры состояния системы 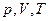 :
:
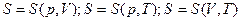
Она имеет размерность теплоемкости. В термодинамике её определяют через дифференциальное соотношение:
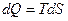 (10.8)
(10.8)
Из (10.5) следует, что для обратимого цикла Карно 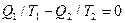 или, т.к.
или, т.к. 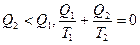 (10.9)
(10.9)
Это соотношение справедливо для любого обратимого цикла 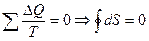 или
или 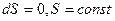 .
.
Отсюда следует, что для любых обратимых циклов энтропия остается постоянной.
Если цикл необратимый, то 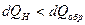 и для такого цикла
и для такого цикла 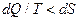 . Если система теплоизолирована (
. Если система теплоизолирована (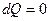 ), то для нее
), то для нее 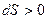 , т.е. в ней возможны процессы, для которых энтропия возрастает.
, т.е. в ней возможны процессы, для которых энтропия возрастает.
С помощью энтропии математически формулируется второе начало термодинамики.
В изолированных системах возможны лишь процессы, при которых энтропия возрастает: 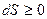 .
.
Итак, второе начало термодинамики связано с необратимостью реальных процессов, что, в свою очередь, обусловлено молекулярной природой тепловых процессов, хаотичным движением молекул.
Из опыта известно, что в системе, состоящей из большого числа хаотически движущихся молекул, могут возникнуть самопроизвольные процессы, приводящие систему к равновесному состоянию (выравнивание температур, концентраций и т.д.). Обратные из процессы практически не наблюдаются, т.е. они маловероятны. Таким образом, необратимость тепловых процессов имеет вероятностный характер.
В равновесном состоянии частицы равномерно распределены по всему объему тела, поэтому вероятность такого состояния наибольшая, следовательно, процессы идут в сторону увеличения вероятности состояния. С другой стороны, энтропия процесса возрастает, т.е. энтропия системы связана с вероятностью состояния, в этом заключается статистический смысл энтропии и второго начала термодинамики.
Количественной характеристикой теплового состояния тела может служить число микроскопических способов, которым это состояние может быть осуществлено. Это число называют термодинамической вероятностью или статистическим весом 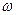 . Как следует из вышесказанного, должна существовать функциональная зависимость между
. Как следует из вышесказанного, должна существовать функциональная зависимость между 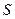 и
и 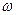 .
.
Такая зависимость была установлена Л. Больцманом, который показал, что:
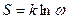 (10.10)
(10.10)
где 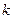 - постоянная Больцмана.
- постоянная Больцмана.
| Лекция 16 | Реальные газы. Сила и потенциальная энергия межмолекулярного взаимодействия. |
| Уравнение Ван-дер-Ваальса для реального газа. Изотермы уравнения. Метастабильные состояния. |
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 348; Нарушение авторских прав?; Мы поможем в написании вашей работы!