
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Критическое состояние вещества
|
|
|
|
Уравнение состояния реального газа (уравнение Ван-дер-Ваальса)
Для 1 моля идеального газа уравнение состояния имеет вид  , где
, где  - объем, предоставленный молекулам газа. Для реальных газов некоторая его часть
- объем, предоставленный молекулам газа. Для реальных газов некоторая его часть  занята самими молекулами. Поэтому объем
занята самими молекулами. Поэтому объем  надо заменить разностью
надо заменить разностью  .
.
Учтем теперь взаимодействие молекул. Силы притяжения, действующие между молекулами, приводят, к уменьшению давления газа на стенки сосуда на некоторую величину  , так что:
, так что:
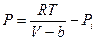 или
или (11.1)
(11.1)
где  - дополнительное давление, обусловленное силами притяжения. Его называют также внутренним или молекулярным давлением. Это давление пропорционально концентрации молекул и силе, действующей на данную молекулу со стороны остальных, которая в свою очередь, также пропорциональна концентрации молекул. Таким образом,
- дополнительное давление, обусловленное силами притяжения. Его называют также внутренним или молекулярным давлением. Это давление пропорционально концентрации молекул и силе, действующей на данную молекулу со стороны остальных, которая в свою очередь, также пропорциональна концентрации молекул. Таким образом,  или
или  , где
, где 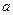 - постоянная, характеризующая силы молекулярного притяжения и зависящая от природы газа. Таким образом, получаем для 1 моля уравнение:
- постоянная, характеризующая силы молекулярного притяжения и зависящая от природы газа. Таким образом, получаем для 1 моля уравнение:
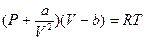 (11.2)
(11.2)
Это уравнение состояния реального газа или уравнение Ван-дер-Ваальса; 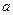 и
и  - константы, определяемые экспериментально. Исследуем уравнений (11.2), для чего перепишем его в виде:
- константы, определяемые экспериментально. Исследуем уравнений (11.2), для чего перепишем его в виде:
 (11.3)
(11.3)
 С его помощью можно построить теоретические изотермы реального газа - зависимость
С его помощью можно построить теоретические изотермы реального газа - зависимость  от
от  при заданных значениях
при заданных значениях 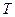 .
.
 Уравнение (11.3) - уравнение третьей степени относительно
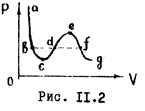
Уравнение (11.3) - уравнение третьей степени относительно  . Поэтому оно может иметь либо три действительных корня, либо один. Одна из таких изотерм изображена на рис. 11.2. На участках
. Поэтому оно может иметь либо три действительных корня, либо один. Одна из таких изотерм изображена на рис. 11.2. На участках  ,
, , т.е. с увеличением давления объем уменьшается, на участке же
, т.е. с увеличением давления объем уменьшается, на участке же  , что соответствует неестественному состоянию вещества, когда сжатие приводит к увеличению объема. Поэтому на опыта изотерма пожег быть лишь вида
, что соответствует неестественному состоянию вещества, когда сжатие приводит к увеличению объема. Поэтому на опыта изотерма пожег быть лишь вида  (Рис. 11.3). Такая изотерма действительно была получена Т. Эндрьюсом с углекислотой. Наличии горизонтального участка связано с тем, что при изменении объема вещество не может все время оставаться в однофазном состоянии. В некоторый момент происходит скачкообразной изменение состояния вещества и его распадение на две фазы: жидкую (
(Рис. 11.3). Такая изотерма действительно была получена Т. Эндрьюсом с углекислотой. Наличии горизонтального участка связано с тем, что при изменении объема вещество не может все время оставаться в однофазном состоянии. В некоторый момент происходит скачкообразной изменение состояния вещества и его распадение на две фазы: жидкую ( ) и газообразную (
) и газообразную ( ). Горизонтальный участок (
). Горизонтальный участок ( ) соответствует двухфазному состоянию вещества - переходу газа в жидкость при заданных температуре и давлении. Эта область насыщенного пара.
) соответствует двухфазному состоянию вещества - переходу газа в жидкость при заданных температуре и давлении. Эта область насыщенного пара.
| Лекция 17 | Изотермы реальных газов. Сравнение уравнения Ван-дер-Ваальса с экспериментальными данными. |
| Фазовые переходы 1-го и 2-го рода. Критическое состояние. |
Экспериментальные изотермы при различных температурах изображены на рис. 11.4. Как видно, с ростом температуры горизонтальные участки становятся все короче. При некоторой температуре прямолинейный отрезок исчезает и на изотерме остается лишь точка перегиба  . Это означает, что исчезает переход из газообразного состояния в жидкое и наоборот, исчезает разница между жидким и газообразным.
. Это означает, что исчезает переход из газообразного состояния в жидкое и наоборот, исчезает разница между жидким и газообразным.
 Это состояние называется критическим состоянием, а температура, при которой оно наступает - критической температурой
Это состояние называется критическим состоянием, а температура, при которой оно наступает - критической температурой  . Понятие критической температуры было введено Д. И. Менделеевым.
. Понятие критической температуры было введено Д. И. Менделеевым.
При температурах выше критической вещество может существовать только в газообразном состоянии и никакими способами не может быть переведено в жидкое.
Критической температуре  соответствует критическое давление
соответствует критическое давление  и критический объем
и критический объем  . Совокупность этих величин и характеризует критическое состояние. Так, например, для воды
. Совокупность этих величин и характеризует критическое состояние. Так, например, для воды  ; для углекислого газа
; для углекислого газа  ; для водорода
; для водорода  . Критические параметры
. Критические параметры  связаны с поправками
связаны с поправками 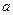 и
и  уравнения Ван-дер-Ваальса.
уравнения Ван-дер-Ваальса.
Уравнение (11.3), как говорилось, может иметь либо три действительных корня - ниже  , либо один при
, либо один при  . Поэтому (11.3) можно в этом случае записать в виде:
. Поэтому (11.3) можно в этом случае записать в виде:

Сравнивая коэффициенты этого уравнения с (11.3) при одинаковых степенях, где  , получаем:
, получаем:
 , откуда
, откуда
 .
.
| Лекция 18 | Внутренняя энергия реального газа. Эффект Джоуля – Томсона и его физическая сущность. |
| Сжижение газов и получение низких температур. |
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 645; Нарушение авторских прав?; Мы поможем в написании вашей работы!