
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон действующих масс. Правило Вант-Гоффа
|
|
|
|
Энергия активации химической реакции
Для того, чтобы произошла химическая реакция, молекулы взаимодействующих веществ должны столкнуться. Не всякое столкновение молекул является эффективным, т. е. таким, чтобы произошло ослабление или разрыв связей между атомами во взаимодействующих молекулах и перегруппировка этих атомов в новые молекулы. Это происходит только в том случае, если энергия взаимодействующих молекул превышает некоторую пороговую энергию. Эта энергия получила название энергии активации: молекулы, обладающие энергией активации, называются активными молекулами. Только взаимодействие активных молекул приводит к протеканию химической реакции и образованию молекул нового вещества.
Любая химическая реакция начинается с разрыва или ослабления связей между атомами в молекулах исходных веществ, при этом реагирующие между собой вещества переходят в неустойчивое промежуточное состояние, характеризующееся большим запасом энергии. Это состояние называется активированным комплексом. Именно для его образования и необходима энергия активации. Активированный комплекс существует очень короткое время и распадается с образованием продуктов реакции, энергия при этом выделяется.
В простейшем случае активированный комплекс представляет собой конфигурацию атомов, в которой ослаблены старые связи и образованы слабые новые.
Активированный комплекс возникает как промежуточное состояние, как для прямой, так и для обратной реакций. Энергетически он отличается от исходных веществ на величину энергии активации прямой реакции, от конечных веществ - на величину энергии активации обратной реакции.
Скорость химической реакции зависит, прежде всего, от природы реагирующих веществ, а также от условий протекания реакции: концентрации, температуры, давления (для газовых реакций), от облучения и наличия катализаторов.
Молекулярность реакции определяется числом молекул, одновременным взаимодействием которых осуществляется элементарный акт химического превращения.
Различают моно -, би - и тримолекулярные реакции.
Рассмотрим реакцию, протекающей по уравнению
aA + bВ → продукты. (32)
Чтобы осуществилось данное взаимодействие, молекулы веществ А и В должны столкнуться, при этом их суммарная энергия должна превышать среднюю энергию всех молекул на величину энергии активации. Доля таких молекул будет пропорциональна вероятности их столкновения. А эта вероятность, как вероятность сложного события, пропорциональна произведению вероятностей двух событий Л и В, т.е. что молекулы А и В одновременно окажутся в данной точке реакционного пространства Р(АВ) = Р(А)Р(В).
С другой стороны, вероятности Р(А) и Р(В) пропорциональны числу молекул А и В, т.е. пропорциональны их концентрации. Следовательно, вероятность одновременного присутствия молекул А и В в одной и той же точке будет пропорциональна произведению их концентраций.
Таким образом, скорость химической реакции пропорциональна произведению концентраций реагирующих веществ - закон действующих масс.
Для реакции вида (32) этот закон примет следующий вид:
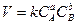 , (33)
, (33)
где СА и СВ - концентрации реагирующих веществ А и В соответственно; а и b - их стехиометрические коэффициенты; К - константа скорости реакции, численно равная скорости химической реакции, когда концентрации реагирующих веществ равны одному моль на литр, либо их произведение равно единице. К уже не зависит от концентрации реагирующих веществ, но зависит от температуры.
Уравнение (33) называется кинетическим уравнением реакции. Показатели а и b называются порядками реакции по веществам А и В соответственно. Их сумма (a + b) называется общим или суммарным порядком реакции.
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 703; Нарушение авторских прав?; Мы поможем в написании вашей работы!