
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электродный потенциал
Электрохимические процессы
ЛЕКЦИЯ 14
ЭЛЕКТРОХИМИЯ
Электрохимические процессы - это процессы взаимного превращения химической и электрической форм энергии.
Их можно разделить на две группы:
1. Процессы превращения химической энергии в электрическую
(гальванический элемент).
2. Процессы превращения электрической энергии в химическую (электролиз).
Электрохимическая система состоит из двух электродов и ионного проводника между ними.
Электродами называются проводники, имеющие электронную проводимость; это так называемые проводники первого рода.
Ионным проводником, т. е. проводником второго рода, служат растворы или расплавы электролитов, а также твердые растворы.
Для обеспечения работы системы электроды соединяют друг с другом металлическим проводником, который называют внешней цепью электрохимической системы.
Рассмотрим процессы, протекающие при погружении металлов в раствор собственных ионов.
В узлах кристаллической решетки металла расположены катионы, находящиеся в равновесии со свободными электронами.
Ме+ · ē 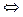 Ме+ + ē.
Ме+ + ē.
При погружении металла в водный раствор начинается взаимодействие поверхностных катионов с полярными молекулами воды, ориентированными у поверхности электрода. В результате этого взаимодействия происходит окисление металла, его ионы переходят в раствор, гидратируются, а в металле остаются электроны, заряд которых не скомпенсирован положительно заряженными ионами:
Ме + mH2 О → Me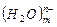 + nē.
+ nē.
Поверхность металла становится заряженной отрицательно, а раствор - положительно. Положительные ионы из раствора притягиваются к отрицательно заряженной поверхности металла. В результате на границе раздела металл -раствор возникает двойной электрический слой. Между металлом и раствором возникает разность (скачок) потенциалов, которая называется электродным потенциалом.
По мере перехода ионов в раствор растет отрицательный заряд поверхности металла и соответственно положительный заряд раствора, что препятствует дальнейшему окислению металла.
Наряду с этой реакцией происходит и обратная реакция, т. е. восстановление ионов металла до атомов

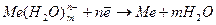 .
.
С увеличением скачка потенциала между электродом и раствором скорость прямой реакции падает, а обратной реакции растет. При некотором значении электродного потенциала скорость прямой реакции станет равной скорости обратной реакции, т. е. установится равновесие.
Потенциал, устанавливающийся в условиях равновесия электродной реакции, называется равновесным электродным потенциалом.
Абсолютное значение равновесного электродного потенциала экспериментально определить невозможно, можно определить только разность электродных потенциалов. Поэтому находят разность потенциалов измеряемого электрода и электрода, потенциал которого условно принимается равным нулю.
|
|
Дата добавления: 2014-01-06; Просмотров: 375; Нарушение авторских прав?; Мы поможем в написании вашей работы!