
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Глицилаланиллизин
|
|
|
|
Последовательность остатков α-аминокислот в пептидах и бел-
ках характеризует первичную структуру.
Химические свойства пептидов вытекают из их амидной природы, они способны гидролизоваться в кислой и щелочной средах, в организме гидролиз осуществляется при участии ферментов - протеиназ. Гидролиз пептидов дает сведения об α-аминокислотах, входящих в их состав, при этом необходимо учитывать, что некоторые аминокислоты частично или полностью разрушаются в условиях жесткого кислотного гидролиза. При гидролизе пептидов полностью теряется информация о порядке соединения α-аминокислот в цепи, т.е. о первичной структуре пептидов и белков.
В проявлении биологических функций пептидов и белков очень важно их пространственное строение. Оно в значительной мере определяется электронным строением пептидной группы.
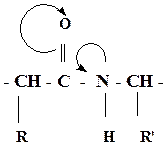
p, π - сопряжение в пептидной группе приводит к частичной двоесвязанности С-Nсвязи, что затрудняет вращение вокруг этой связи
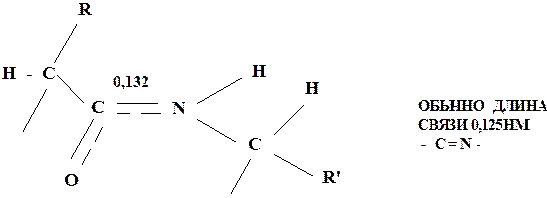
Такая частичная двоесвязанность C-N связи означает, что пептидная группа представляет собой плоский участок пептидной цепи, рядом с которым находятся атомы С своеобразные шарниры где возможно вращение вокруг связей С - С и N - C
Т.О. кроме первичной структуры полипептидной цепи существует
более высокий уровень ее структурной организации - вторичная
структура: пространственное расположение цепи (конформация), фиксируемое водородными связями. Отдельные участки цепи образуют α-спираль, что впервые было показано Полингом.
В одном витке спирали умещаются
3,6 аминокислотных остатка, т.е. каждая аминокислота связывается с 5-ой по счету в первичной последовательности. Например, в последовательности Гли - Ала - Фен - Глу - Сер - Ала остаток глицина образует водородную связь с остатком серина
Кроме водородных связей могут быть и другие виды взаимодействий, приводящие к стабилизации цепи в пространстве: ионные взаимодействия между заряженными группами СОО и NН2 ковалентные связи S - S за счет окисления групп SH остатков цистеина.
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 415; Нарушение авторских прав?; Мы поможем в написании вашей работы!