
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реальные газы. Уравнение Ван-дер-Ваальса
|
|
|
|
Газовые законы, рассмотренные в предыдущих разделах, точно выполняются только для идеальных газов, которые не конденсируются при охлаждении их вплоть до абсолютного нуля температуры.
Свойства большинства газов близки к свойствам идеального газа, когда они находятся при температурах, достаточно далеких от точки конденсации, т.е. когда между молекулами отсутствует взаимодействие и когда собственный объем молекул газа мал по сравнению с объемом газа.
Вблизи точки конденсации (при высоком давлении и низкой температуре) свойство газов значительно отличается от свойств идеального газа. В этих случаях говорят о реальных газах.
Уравнение состояния для 1-го моля идеального газа  (Vm – молярный объем) видоизменяется в случае реальных газов.
(Vm – молярный объем) видоизменяется в случае реальных газов.
Для реальных газов необходим учет собственного объема молекул.
Наличие сил отталкивания, которые противодействуют проникновению в занятый молекулой объем других молекул, сводится к тому, что фактический свободный объем, в котором могут двигаться молекулы реального газа, будет не Vm , а Vm – b, b – объем, занимаемый самими молекулами. Объем b равен учетверенному собственному объему молекул.
Действие сил притяжения газа приводит к появлению дополнительного давления на газ, называемого внутренним давлением. По вычислениям Ван-дер-Ваальса, внутреннее давление обратно пропорционально квадрату молярного объема, т.е.
 ,
,
где a — постоянная Ван-дер-Ваальса, характеризующая силы межмолекулярного притяжения.
Вводя поправки в уравнение 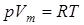 для идеального газа, получим уравнение Ван-дер-Ваальса для 1-го моля газа
для идеального газа, получим уравнение Ван-дер-Ваальса для 1-го моля газа
 . (9.45)
. (9.45)
Учитывая, что  , получим уравнение для произвольного количества вещества:
, получим уравнение для произвольного количества вещества:
 (9.46)
(9.46)
Поправки Ван-дер-Ваальса (a и b) являются постоянными для каждого газа величинами. Для их определения записывают уравнения для двух известных из опыта состояний газа и решаются относительно a и b.
Уравнение (9.45) можно записать в виде
 .
.
При заданных p и T — это уравнение третьей степени относительно Vm, следовательно, оно может иметь либо три вещественных корня, либо один вещественный и два мнимых, причем физический смысл имеют лишь вещественные положительные корни.
Изотермами Ван-дер-Ваальса называются кривые зависимости p от Vm при заданных T, определяемые уравнением Ван-дер-Ваальса для моля газа.
При некоторой температуре Tk — критической температуре — на изотерме (рис. 9.11.) только одна точка перегиба (в этой точке касательная к ней параллельна оси абсцисс). Точка K — критическая точка, соответствующие
 этой точке объем Vk и давление pk называются также критическими. Изотерма при Tk называется критической изотермой.
При высокой температуре (T>Tk) изотерма реального газа отличается от изотермы идеального газа только некоторым искажением ее формы, оставаясь монотонно спадающей кривой. При низкой температуре (T<Tk) изотермы имеют волнообразный участок, сначала монотонно опускаясь вниз, затем монотонно поднимаясь вверх и снова монотонно опускаясь. этой точке объем Vk и давление pk называются также критическими. Изотерма при Tk называется критической изотермой.
При высокой температуре (T>Tk) изотерма реального газа отличается от изотермы идеального газа только некоторым искажением ее формы, оставаясь монотонно спадающей кривой. При низкой температуре (T<Tk) изотермы имеют волнообразный участок, сначала монотонно опускаясь вниз, затем монотонно поднимаясь вверх и снова монотонно опускаясь.
|
Изотермам при низкой температуре (T<Tk) одному значению давления например, p1 соответствует три значения объема V1, V2 и V3, а при T>Tk — одно значение объема. В критической точке все три объема (три корня) совпадают и равны Vk.
Рассмотрим изотерму при T<Tk на рис. 9.12.
 | |||
 | |||
На участках 1–3 и 5–7 при уменьшении объема Vm давление p возрастает. На участке 3–5 сжатие вещества приводит к уменьшению давления; практика же показывает, что такие состояния в природе не осуществляются. Наличие участка 3–5 означает, что при постепенном изменении объема вещество не может оставаться все время в виде однородной среды; в некоторый момент должно наступить скачкообразное изменение состояния и распад вещества на две фазы. Таким образом, истинная изотерма имеет вид ломанной линии 7–6–2–1. Часть 7–6 отвечает газообразному состоянию, а часть 2–1 — жидкому. В состояниях, соответствующих горизонтальному участку изотермы 6–2, наблюдается равновесие жидкой и газообразной фаз вещества.
Если через крайние точки горизонтальных участков семейства изотерм провести линию, то получится колокообразная кривая (рис. 9.13.), ограничивающая область двухфазных состояний вещества. Эта кривая и критическая изотерма делят диаграмму p, Vm под изотермой на три области: под колокообразной кривой располагается область двухфазных состояний (жидкость и насыщенный пар), слева от нее находится область жидкого состояния, а справа— область пара. Пар — вещество, находящееся в газообразном состоянии при температуре ниже критической. Насыщенный пар — пар, находящийся в равновесии со своей жидкостью.
Контрольные вопросы
1. Газ совершает над граничащими с ним телами отрицательную работу. Что происходит при этом с объемом газа?
2. Может ли случится, что газ получает теплоту, а его внутренняя энергия уменьшается?
3. Изменяется ли внутренняя энергия идеального газа при изотермическом расширении?
4. Всегда ли справедливо соотношение Cp-CV=R?
5. В ходе какого процесса работа, совершаемая телом, пропорциональна изменению его объема?
6. Чему равна работа, совершаемая в изохорическом процессе?
7. В ходе какого процесса работа, совершаемая телом, равна убыли его внутренней энергии?
8. Что такое вечный двигатель второго рода?
9. Может ли энтропия убывать в ходе необратимого процесса?
10. Какие величины, которыми пренебрегают, рассматривая идеальные газы, учитывает уравнение Ван-дер-Ваальса?
Задачи к главам 8, 9
1. Рассмотрим модель идеального газа, заключенного в сосуд. Завышены или занижены по сравнению с реальным газом (при заданных V и Т) значения: а) внутренней энергии; б) давления газа на стенку сосуда?
2. Внутренняя энергия некоторого газа 55 МДж, причем на долю энергии вращательного движения приходится 22 МДж. Сколько атомов в молекуле данного газа?
3. Молекулы какого из перечисленных газов, входящих в состав воздуха, в равновесном состоянии обладают наибольшей средней арифметической скоростью? 1)N2; 2) О2; 3) H2; 4) CO2.
4. Некоторый газ с неизменной массой переводится из одного равновесного состояния в другое. Изменяется ли в распределении молекул по скоростям: а) положение максимума кривой Максвела; б) площадь под этой кривой?
5. Объем газа увеличивается, а температура уменьшается. Как изменяется давление? Масса постоянна.
6. При адиабатном расширении газа объем его изменяется от V 1 до V 2. Сравнить отношения давлений (p 1/ p2), если газ: а) одноатомный; б) двухатомный.
7. Аэростат с эластичной герметической оболочкой поднимается в атмосфере. Температура и давление воздуха уменьшаются с высотой. Зависит ли подъемная сила аэростата: а) от давления воздуха; б) от температуры?
8.
 |
На рисунке изображены адиабаты для двух газов H2 и Ar. Указать какие графики соответствуют H2. 1)I, III; 2)I, IV; 3)II, III; 4)II,IV.
9. Сравнить работы расширения газа при изотермическом изменении объема от 1 до 2 м3 и от 2 до 4 м3.
10. Газ, расширяясь, переходит из одного и того же состояния с объемом V 1 до объема V 2: а) изобарно; б) адиабатно; в) изотермически. В каких процессах газ совершает наименьшую и наибольшую работы?
11. Какой из указанных газов при комнатной температуре имеет наибольшую удельную теплоемкость?
1) O2; 2) H2; 3) He; 4) Ne; 5) I2.
12. Как изменяется внутренняя энергия газа в процессах расширения: а) в изобарном; б) в адиабатном?
13. Дан неизвестный газ. Можно ли узнать, какой это газ, если заданны:
а) p, V, T, m; б) p, T, r; в) g, СV? К газу применима классическая теория
теплоемкостей.
14. Определить знаки молярной теплоемкости газа (m =const, молекулы газа жесткие) в процессе, для которого T2V= const, если газ: а) одноатомный; б) двухатомный.
15. Перейдем от модели идеального газа к модели, в которой учитываются силы притяжения между молекулами. Как изменяются молярные теплоемкости CV и Cp при заданных V и T?
16. Идеальный газ, содержащий N молекул, расширяется при постоянной температуре. По какому закону увеличивается число микросостояний газа w? 1) w ~ V; 2) w ~ VN; 3) w ~ ln V; 4) не приведено верного соотношения.
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 1229; Нарушение авторских прав?; Мы поможем в написании вашей работы!