
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ковалентная (гомеополярная) связь
|
|
|
|
Ковалентная связь возникает в результате взаимного притяжения нейтральных атомов. Примерами молекул с ковалентной связью могут служить 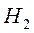 ,
, 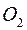 ,
,  ,
,  ,
,  .
.
Рассмотрим ковалентную связь на примере молекулы водорода 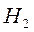 . Теорию молекулы водорода разработали В.Гайтлер и Ф.Лондон (1927 г.).
. Теорию молекулы водорода разработали В.Гайтлер и Ф.Лондон (1927 г.).
 |
Молекула
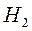 представляет собой систему, состоящую из двух протонов и двух электронов. В основе квантово-механического объяснения ковалентной связи молекулы
представляет собой систему, состоящую из двух протонов и двух электронов. В основе квантово-механического объяснения ковалентной связи молекулы  лежит принципиальная неразличимость электронов в молекуле. Тождественность электронов приводит к существованию квантово-механического обменного взаимодействия.
лежит принципиальная неразличимость электронов в молекуле. Тождественность электронов приводит к существованию квантово-механического обменного взаимодействия.
Если расстояние между протонами невелико, то пси-функции атомов 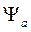 и
и  перекрываются. Из-за большой массы ядер по сравнению с массами электронов движением ядер можно пренебречь (это так называемое адиабатическое приближение). В этом приближении оператор Гамильтона
перекрываются. Из-за большой массы ядер по сравнению с массами электронов движением ядер можно пренебречь (это так называемое адиабатическое приближение). В этом приближении оператор Гамильтона 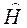 для четырех частиц молекулы
для четырех частиц молекулы 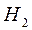 можно представить как
можно представить как  , где
, где
 определяют энергию взаимодействия электронов со своими ядрами,
определяют энергию взаимодействия электронов со своими ядрами,
 - потенциальная энергия взаимодействия частиц, относящихся к разным атомам системы.
- потенциальная энергия взаимодействия частиц, относящихся к разным атомам системы.
Уравнение Шредингера для независимых атомов водорода
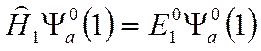

Будем рассматривать невозбужденное состояние молекулы  , поэтому каждый из атомов водорода должен находиться в состоянии
, поэтому каждый из атомов водорода должен находиться в состоянии 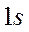 .
.
Волновая функция системы двух невзаимодействующих атомов водорода -  . Поскольку электроны тождественны, то можно описать систему
. Поскольку электроны тождественны, то можно описать систему  .
.
Волновая функция такой системы является линейной суперпозицией указанных произведений:
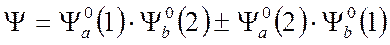
Волновая функция с «+» является симметричной относительно перестановки координат электронов, а волновая функция с «-» - антисимметричной. Подстановка этой функции в решение уравнения Шредингера для определения полной энергии системы приводит к выражению
 ,
,
где 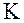 ,
, 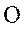 ,
,  - интегралы кулоновский, обменный и интеграл перекрытия:
- интегралы кулоновский, обменный и интеграл перекрытия:


 .
.
Функции  и
и  являются решениями уравнения Шредингера в первом приближении (с учетом
являются решениями уравнения Шредингера в первом приближении (с учетом  - энергии взаимодействия) и отличаются от функций
- энергии взаимодействия) и отличаются от функций 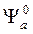 и
и 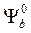 , но сохраняют характер симметрии.
, но сохраняют характер симметрии.
Кулоновский интеграл  характеризует электростатическое взаимодействие заряженных частиц в молекуле.
характеризует электростатическое взаимодействие заряженных частиц в молекуле.
Интеграл перекрытия  показывает степень перекрытия волновых функций атомов и изменяется от 0 (при
показывает степень перекрытия волновых функций атомов и изменяется от 0 (при  ) до 1 (при
) до 1 (при 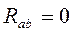 ).
).
Обменный интеграл 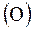 описывает энергию обменного взаимодействия. Эта энергия специфична не только для кулоновского взаимодействия. Она появляется в системе любых тождественных частиц и не зависит от природы сил взаимодействия между ними. Этот интеграл имеет знак “-” и зависит от расстояния
описывает энергию обменного взаимодействия. Эта энергия специфична не только для кулоновского взаимодействия. Она появляется в системе любых тождественных частиц и не зависит от природы сил взаимодействия между ними. Этот интеграл имеет знак “-” и зависит от расстояния 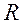 между ядрами.
между ядрами.
 , поэтому обменное взаимодействие вносит основной вклад в энергию химической связи.
, поэтому обменное взаимодействие вносит основной вклад в энергию химической связи.
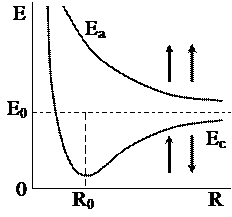 Упрощенно можно записать
Упрощенно можно записать 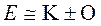 .
.
Если 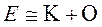 ,то волновая функция
,то волновая функция 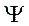 - симметричная, спины электронов направлены противоположно и возникает связывающее состояние
- симметричная, спины электронов направлены противоположно и возникает связывающее состояние  .
.
Если  , то волновая функция
, то волновая функция  - антисимметрична, спины электронов параллельны и состояние – антисвязывающее
- антисимметрична, спины электронов параллельны и состояние – антисвязывающее 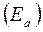 .
.
Энергия системы в соответствии с ориентацией спинов будет иметь разные зависимости от 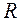 . Энергия
. Энергия 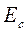 имеет минимум на расстоянии
имеет минимум на расстоянии  , которое определяет устойчивое состояние системы.
, которое определяет устойчивое состояние системы.
Возникновение связывающих и антисвязывающих состояний в молекуле водорода:
a) Два атома  находятся в основном состоянии на большом расстоянии, их волновые функции не перекрываются.
находятся в основном состоянии на большом расстоянии, их волновые функции не перекрываются.
b) Если спины электронов противоположны (синглетное состояние), то волновые функции электронов перекрываются и электронное облако сосредоточено между ядрами; отрицательный заряд этого облака компенсирует силу кулоновского отталкивания ядер; это стабильная система – молекула  .
.
c)
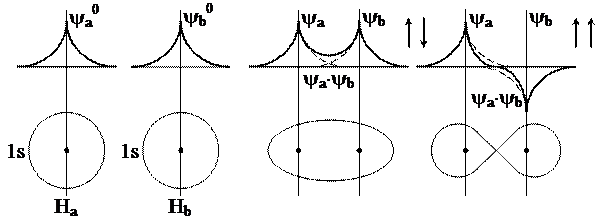 |
Если спины электронов параллельны (триплетное состояние), то электронный заряд находится по разные стороны от ядер и молекула образоваться не может.
Устойчивая молекула  образуется при условии антипараллельности спинов электронов.
образуется при условии антипараллельности спинов электронов.
Существует два типа молекул водорода – параводород и ортоводород. Отличие этих молекул состоит в разной взаимной ориентации спинов, но не электронов, а ядер: у параводорода спины ядер антипараллельны, а у ортоводорода – параллельны.
Мы описали простейшую молекулярную систему – молекулу водорода и получили волновые функции, описывающие электронные состояния этой системы. Эти волновые функции получили название молекулярных орбиталей (МО). Если атомные орбитали (АО) – это волновые функции валентных электронов, то молекулярная орбиталь – это волновая функция электрона, который представляется «размазанным» по всей молекуле и принадлежит всем атомам, входящим в состав молекулы.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 562; Нарушение авторских прав?; Мы поможем в написании вашей работы!