
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Коррозия металлов
|
|
|
|
Коррозия – самопроизвольное разрушение металлов, вследствие физико-химического взаимодействия их с окружающей средой.
По характеру разрушения коррозионные процессы можно разделить на сплошную коррозию и локальную (местную) коррозию. В первом случае поверхность металла окисляется с одинаковой скоростью на всех участках поверхности. Во втором случае на поверхности металла появляются участки с большей скоростью коррозии, там появляются пятна, трещины и другие повреждения.
Один из видов локальной коррозии – селективная, или избирательная, она происходит в сплавах, где разрушаются кристаллы наиболее активного металла.
Другой вид локальной коррозии – межкристаллитная коррозия, она происходит по границам кристаллитов.
По механизму действия коррозия бывает химической и электрохимической:
Химическая коррозия возникает, когда металл эксплуатируется в среде, не проводящей электрический ток: растворы неэлектролитов и сухая атмосфера воздуха (влажность менее 65%, температура менее 100°С или влажность более 65%, температура более 100°С). В сухой атмосфере воздуха происходит взаимодействие металлов с газами, такими как: O2 и Cl2:
4Al + 3O2 = 2Al2O3
2Al + 3Cl2 = 2AlCl3
При химической коррозии окисление металла и восстановление газа происходит одновременно, на одном участке поверхности, т. е. они пространственно не разделены.
Электрохимическая коррозия протекает в электропроводных средах: растворах кислот, щелочей, солей, во влажной атмосфере воздуха (влажность более 65%, температура менее 100°С). В этих условиях возможна конденсация паров воды на поверхности металлов. Электрохимическая коррозия проявляется в следующих случаях:
1. Два металла, взятые в виде кусков, пластин, проволоки контактируют друг с другом и раствором электролита, при этом более активный металл будет анодом, он будет окисляться, а менее активный металл будет катодом, на нём будет происходить восстановление частиц электролита.
2. Если поверхность металла окислена, то тоже возможна электрохимическая коррозия, при этом окисленные участки будут катодом, а не окисленные – анодом.
3. Причиной электрохимической коррозии могут быть и примеси других металлов, более или менее активных, чем основной.
4. Коррозионная гальванопара может возникнуть и за счёт разной концентрации растворов, касающихся металлической поверхности на разных участках.
5. Электрохимическая коррозия может протекать и тогда, когда разные части металлического изделия находятся в разных условиях, неодинаково нагреты, освещены и т. д.

 Рассмотрим образование коррозионной гальванопары на примере латуни: Zn – Cu
Рассмотрим образование коррозионной гальванопары на примере латуни: Zn – Cu
A Zn | HCl | Cu K
анодный процесс: Zn – 2e = Zn2+ - окисление
катодный процесс: 2H+ + 2e = H2 - восстановление
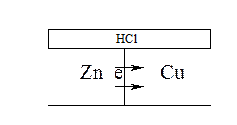
Перетекание электронов с анодных участков на катодные называется катодной поляризацией. Снятие электронов с катодных участков ионами водорода называется водородной деполяризацией, а ионы водорода – деполяризаторами. В кислых средах, не содержащих растворённого кислорода, коррозия протекает только с водородной деполяризацией.
Данное уравнение будет выглядеть так:
Zn + 2H+ = Zn2+ + H2↑
Zn + 2HCl = ZnCl2 + H2↑
Продукты коррозии: ZnCl2 и H2↑. Хлорид цинка - растворимая в воде соль, значит, поверхность металла она не защищает, и растворение цинка идёт до конца.
Вывод: латунные изделия нельзя эксплуатировать в кислой среде.

 Рассмотрим коррозию латуни во влажной атмосфере воздуха.
Рассмотрим коррозию латуни во влажной атмосфере воздуха.
 A Zn | Н2O, O2 | Cu K
A Zn | Н2O, O2 | Cu K
анодный процесс: 2 Zn – 2e = Zn2+
 катодный процесс: 1 2H2O + O2 + 4e = 4OH–
катодный процесс: 1 2H2O + O2 + 4e = 4OH–
2Zn + 2H2O + O2 = 2Zn2+ + 4OH–
2Zn + 2H2O + O2 = 2Zn(OH)2↓
Вывод: латунные изделия можно эксплуатировать во влажной атмосфере воздуха, так как образуется нерастворимое соединение, защищающее поверхность от дальнейшей коррозии. Процесс идёт с кислородной деполяризацией.

 Рассмотрим пример контакта двух металлов Al – Cu:
Рассмотрим пример контакта двух металлов Al – Cu:
 A Al | Н2O | Cu K
A Al | Н2O | Cu K
анодный процесс: 2 Al – 3e = Al3+
катодный процесс: 3 2H2O + 2e = H2 + 2OH–
 2Al + 6H2O = 2Al3+ + 3H2 + 6OH–
2Al + 6H2O = 2Al3+ + 3H2 + 6OH–
2Al + 6H2O = 2Al(OH)3↓ + 3H2
Процесс идёт с водородной деполяризацией.
Термодинамическая вероятность электрохимической коррозии.
Основной причиной электрохимической коррозии является термодинамическая неустойчивость металла в данной среде. Т. к. коррозия – процесс самопроизвольный, то ΔG < 0, ΔG = – Amax, Amax = nFΔE, где ΔE = EK – EA Þ если ΔE > 0, то EK > EA. Т. е., чтобы процесс не шёл самопроизвольно, мы должны выбрать такой металл, для которого EK < EA.
Классификация металлов по их термодинамической неустойчивости в наиболее распространённых коррозионных средах.
1. Кислая среда (без кислорода).
Катодный процесс: 2H+ + 2e = H2, EK = 0, ΔE > 0, EA < 0, т. е. в кислой среде по ряду напряженияй металлов будут подвергаться коррозии Li – W.
2. Нейтральная среда (без кислорода).
Катодный процесс: H2O + 2e = H2 + 2OH–, 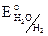 = – 0,41 B. Т. е. во влажной атмосфере подвергаются коррозии металлы от Li – Fe по ряду напряжений металлов.
= – 0,41 B. Т. е. во влажной атмосфере подвергаются коррозии металлы от Li – Fe по ряду напряжений металлов.
3. Нейтральная среда (с растворённым кислородом).
Катодный процесс: 2H2O + O2 + 4e = 4OH–, 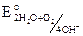 = 0,815 B. Т. е. в нейтральной среде будут корродировать металлы: Li – Ag по ряду напряжений металлов.
= 0,815 B. Т. е. в нейтральной среде будут корродировать металлы: Li – Ag по ряду напряжений металлов.
4. Кислая среда (с растворенным кислородом).
Катодный процесс: 4H+ + O2 + 4e = 2H2O, 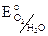 = 1,23 B. Металлы, имеющие меньший электродный потенциал Li – Hg будут корродировать в кислой среде в присутствии кислорода.
= 1,23 B. Металлы, имеющие меньший электродный потенциал Li – Hg будут корродировать в кислой среде в присутствии кислорода.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 592; Нарушение авторских прав?; Мы поможем в написании вашей работы!