
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные понятия и определения. Учение о химической связи находится в центре внимания современной химии
|
|
|
|
ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ
Учение о химической связи находится в центре внимания современной химии. Это и понятно, т. к. химические реакции есть не что иное, как перестройка химических связей в реагирующих частицах. Свойства вещества определяются его составом, а также типом химических связей, объединяющих атомы в молекулы, ионы, или свободные радикалы. Основополагающий вклад в учение о строении химических соединений внес русский химик А. М. Бутлеров.
Химическая связь – это сложные протонно-электронные взаимодействия атомов, которые приводят к образованию молекул простых или сложных веществ или кристаллов.
Признак химической связи – устойчивость образовавшейся молекулы.
Причина устойчивости – понижение полной энергии системы (суммы кинетической и потенциальной энергии) при образовании молекулы из атомов по сравнению с системой отдельных атомов.
В соответствии с современными представлениями, химическая связь образуется в результате электростатического притяжения взаимодействующих частиц и квантово-механического взаимодействия внешних валентных электронов реагирующих атомов. То есть природа химической связи едина – это взаимодействие электрических полей, образуемых электронами и ядрами атомов, участвующих в создании молекулы.
Основные характеристики химической связи:
1. Энергия связи, Есв, определяет ее прочность – это количество энергии, которое нужно затратить на ее разрыв или количество энергии, выделяемое при образовании молекулы из атомов. Единица измерения энергии связи – кДж/моль (эВ/моль). Энергия химической связи изменяется в интервале 40 ÷ 400 кДж/моль.
2. Длина связи, ℓ, - расстояние между центрами двух атомов, образующих молекулу. Измеряется в м (нм) или 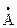 .
.
Ниже приведены характеристики некоторых химических связей:
| Связь | Есв, кДж/моль | ℓ, 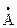
|
| H – H Cl – Cl Br – Br I – I H – Cl H – Br H - I | 435,1 238,9 190,3 152,7 431,0 366,0 299,5 | 0,74 1,99 2,28 2,67 1,28 1,41 1,60 |
3. Валентный угол – угол между прямыми, соединяющими центры ядер атомов в молекуле. Валентными углами определяется пространственное строение молекул. Величины валентных углов зависят от природы атомов и характера связи. Так, простые двухатомные молекулы типа А2 и АВ имеют линейную структуру: их валентные углы равны 180º, т. е. А – А и А – В.
Трехатомные и более сложные молекулы могут обладать различными конфигурациями. Так, 3 – атомная молекула АВ2 может иметь 2 формы: линейная, валентный угол равен 180º; уголковая, валентный угол равен Θ

По характеру распределения электронной плотности в веществе различают три основных типа химической связи: ковалентную, ионную и металлическую. В «чистом» виде перечисленные типы связи проявляются редко. В большинстве соединений имеет место наложение разных типов связи. Кроме того, между молекулами возникает водородная химическая связь и происходят вандерваальсовы взаимодействия.
Правило октета. В результате образования химической связи атомы могут приобретать такую же конфигурацию, как у благородных газов, которые (за исключением гелия) имеют на внешней оболочке восемь (октет) электронов. Стремление к созданию такой устойчивой электронной конфигурации получило название правило октета. Это справедливо как для ионной, так и ковалентной связей.
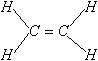
Обозначение химической связи. Электроны внешней оболочки, участвующие в образовании химической связи, могут изображаться точками (формула Льюиса), а связи – черточками. Например:
| Молекула | 
| 
| 
|
| Связь |

| 
|
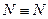
|
| Формула Льюиса |

| 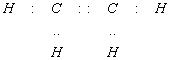
|

|
| Название связи | Простая ковалентная | Двойная ковалентная | Тройная ковалентная |
В настоящее время известны два метода количественного описания химической связи:
1. Метод валентных связей (МВС).
2. Метод молекулярных орбиталей (ММО).
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 174; Нарушение авторских прав?; Мы поможем в написании вашей работы!