
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Доказательства генетической роли нуклеиновых кислот
|
|
|
|
Определение предмета молекулярная биология
Термин "молекулярная биология" принадлежит Фрэнсису Крику, которому надоело в ответ на вопрос о его профессии объявлять себя смесью кристаллографа, биохимика, биофизика и генетика.
После атомной бомбежки Хиросимы и Нагасаки в 1945г. Началось бегство ученых из физики, а в 1947г. Нобелевский лауреат физик Эрвин Шредингер написал книгу "Что такое жизнь с точки зрения физика?", которая привлекла в биологию многих физиков и математиков.
Определение: Молекулярная биология - это наука о механизмах хранения, воспроизведения, передачи и реализации генетической информации, о структуре и функциях нерегулярных биополимеров – нуклеиновых кислот и белков.
Начав с изучения биологических процессов на молекулярно-атомном уровне, молекулярная биология перешла к сложным надмолекулярным клеточным структурам, а в настоящее время успешно решает проблемы генетики, физиологии, эволюции и экологии.
Основные этапы развития молекулярной биологии
1. Романтический период 1935-1944гг.
Макс Дельбрюк и Сальвадор Лурия занимались изучением репродукции фагов и вирусов, представляющих собой комплексы нуклеиновых кислот с белками
В 1940г. Джордж Бидл и Эдуард Татум сформулировали гипотезу - "Один ген -один фермент". Однако, что такое ген в физико-химическом плане тогда еще не знали.
2. Второй романтический период 1944-1953гг.
Была доказана генетическая роль ДНК. В 1953 г. появилась модель двойной спирали ДНК, за которую ее создатели Джеймс Уотсон, Френсис Крик и Морис Уилкинс были удостоены Нобелевской премии.
3. Догматический период 1953-1962гг.
Сформулирована центральная догма молекулярной биологии:
Перенос генетической информации идет в направлении ДНК → РНК → белок
В 1962 г. был расшифрован генетический код.
4. Академический период с 1962г. по настоящее время, в котором с 1974 года выделяют генно-инженерный подпериод.
Ocновныe открытия
1944г. Доказательство генетической роли ДНК. Освальд Эйвери, Колин Мак-Леод, Маклин Мак-Карти.
1953г. Установление структуры ДНК. Джеймс Уотсон, Френсис Крик.
1961г. Открытие генетической регуляции синтеза ферментов. Андре Львов, Франсуа Жакоб, Жак Моно.
1962г. Расшифровка генетического кода. Маршалл Нирнберг, Генрих Маттеи, Северо Очоа.
1967г. Синтез in vitro биологически активной ДНК. Артур Корнберг (неформальный лидер молекулярной биологии).
1970г. Химический синтез гена. Гобинд Корана.
1970г. Открытие фермента обратной транскриптазы и явления обратной транскрипции. Говард Темин, Дэвид Балтимор, Ренато Дульбеко.
1974г. Открытие рестриктаз. Гамильтон Смит, Даниэль Натанс, Вернер Арбер.
1978г. Открытие сплайсинга. Филипп Шарп.
1982г. Открытие автосплайсинга. Томас Чек.
Доказательства генетической роли нуклеиновых кислот
1. 1928г. Опыты Фредерика Гриффита.
Гриффит работал с пневмококками - бактериями, вызывающими пневмонию. Он брал два штамма пневмококков: капсульный и бескапсульный. Капсульный -патогенный (вирулентный), при инфицировании таким штаммом мыши погибают, бескапсульный - непатогенный. При введении мышам смеси убитых нагреванием (и, следовательно, потерявших вирулентность) капсульных пневмококков и живых бескапсульных невирулентных бактерий, животные погибали в результате размножения капсульных вирулентных форм. Обнаруженное явление Гриффит интерпретировал как трансформацию.
Определение: Трансформация - это приобретение одним организмом некоторых признаков другого организма за счет захвата части его генетической информации.
В 1944г. этот эксперимент был повторен Освальдом Эйвери, Колином Мак-Лсодом и Маклином Мак-Карти в варианте смешивания бескапсульных пневмококков с взятыми от капсульных белками, полисахаридами или ДНК. В результате этого эксперимента была выявлена природа трансформирующего фактора.
Трансформирующими фактором оказалась ДНК.
2. 1952г. Эксперимент Альфреда Херши и Марты Чейз. Фаги (бактериофаги) - это вирусы, размножающиеся в бактериях. Е. coli - кишечная палочка (эубактерия).
Суть опыта: фаги, у которых белковая оболочка была мечена радиоактивной серой (S35), а ДНК - радиоактивным фосфором (Р32), инкубировали с бактериями. Затем бактерии отмывали.
В смывных водах не обнаруживали Р32, а в бактериях - S35. Следовательно, внутрь попала только ДНК. Через несколько минут из бактерии выходили десятки полноценных фагов, содержащих и белковую оболочку, и ДНК.
Отсюда следовал однозначный вывод о том, что именно ДНК выполняет генетическую функцию - несет информацию как о создании новых копий ДНК, тик и о синтезе фаговых белков.
3. 1957г. Опыты Френкеля - Конрата.
Френкель-Конрат работал с вирусом табачной мозаики (ВТМ). В этом вирусе содержится РНК, а не ДНК. Было известно, что разные штаммы вируса вызывают разную картину поражения листьев табака. После смены белковой оболочки "переодетые" вирусы вызывали картину поражения, характерную для того штамма, чья РНК была покрыта чужим белком.
Следовательно, не только ДНК, но и РНК может служить носителем генетической информации.
На сегодняшний день существуют сотни тысяч доказательств генетической роли нуклеиновых кислот. Приведенные три являются классическими.
Лекция 2. Строение нуклеиновых кислот
Хронология открытий, по дготовивших создание Уотсоном и Криком модели двойной спирали ДНК.
1869г. Обнаружен нуклеин. Современное название -хроматин. Фридрих Мишер - швейцарский врач.
1889г. Нуклеин разделен на нуклеиновую кислоту и белок. Появился термин "нуклеиновая кислота". Рихард Альтман.
1900г. Все азотистые основания были описаны химиками.
1909г. В нуклеиновых кислотах обнаружены фосфорная кислота и рибоза. Левин
1930г. Найдена дезоксирибоза. Левин.
2 938г. Рентгеноструктурный анализ показал, что расстояние между нуклеотидами в ДНК 3,4 А. При этом азотистые основания уложены стопками. Уильям Астбюри, Флорин Белл.
1947г. С помощью прямого и обратного титрования установлено, что в ДНК есть водородные связи между группами N-H и С=О. Гулланд
1953г. С помощью кислотного гидролиза ДНК с последующей хроматографией и количественным анализом установлены закономерности: А/Т=1; Г/Ц=1; (Г+Ц)/ (А+Т)=К - коэффициент специфичности, постоянен для каждого вида. Эрвин Чаргафф.
Правила Чаргаффа. В ДНК всегда А/Т=1; Г/Ц=1; (Г+Ц)/(А+Т)=К -коэффициент специфичности, постоянен для каждого вида.
 Принципы строения ДНК
Принципы строения ДНК
1. Нерегулярность. Существует регулярный
сахарофосфатный остов, к которо-му присоединены азотистые основания. Их чередование нерегу-лярно.
2. Антипараллельность. ДНК состоит из двух полинуклеотидных цепей, ориентированных антипа-раллельно. 3'-конец одной расположен напротив 5-конца другой.
3. Комплементарность (дополни-тельность). Каждому азотистому основанию одной цепи соответствует строго
определенное азотистое снование другой цепи. Соответствие задается химией. Пурин и пиримидин в паре образуют водородные связи. В паре А-Т две водородные связи, в паре Г — Ц - три.
4. Наличие регулярной вторичной структуры. Две комплементарные, антипараллельно расположенные полинуклеотидные цепи образуют правые спирали с общей осью.
Формы двойной спирали ДНК.
Существуют несколько форм двойной спирали ДНК.
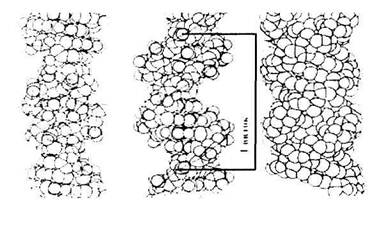 В основной - В-форме на виток приходится 10 комплементарных пар.
В основной - В-форме на виток приходится 10 комплементарных пар.
|
спирали. Соседние комплемен-тарные пары повернуты друг относительно друга на 36о. Диаметр спирали 20Å, причем пуриновый нуклеотид занимает
12Å, а пиримидиновый - 8Å.
А-форма - 11 пар азотистых оснований на виток. Плоскости азотистых оснований отклонены от нормали к оси спирали на 20°. Отсюда следует наличие внутренней пустоты диаметром 5Å. Высота витка 28Å. Такие же параметры у гибрида из одной цепи ДНК и одной цепи РНК.
С-форма - шаг спирали 3lÅ, 9,3 пар оснований на виток, угол наклона к перпендикуляру 6°.
Все три формы - правозакрученные спирали.
Есть еще несколько форм правых спиралей и всего одна левая спираль (Z - форма). Высота витка в Z-форме -44.5Å, на виток приходится 12 пар нуклеотидов. Ни А-, ни Z- формы не могут существовать в водном растворе без дополнительных воздействий (белки или суперспирализация).
Нуклеиновые кислоты являются нерегулярными полимерами, мономеры которых - нуклеотиды.
 Нуклеотид = нуклеозид + фосфорная кислота = азотистое основание + пентоза+ фосфорная кислота.
Нуклеотид = нуклеозид + фосфорная кислота = азотистое основание + пентоза+ фосфорная кислота.
В РНК пентоза - рибоза.
В ДНК - дезоксирибоза.

Нуклеотиды соединяются друг с другом в полимерную цепочку с помощью фосфодиэфирных связей. Азотистые основания не принимают участия в соединении нуклеотидов одной цепи.
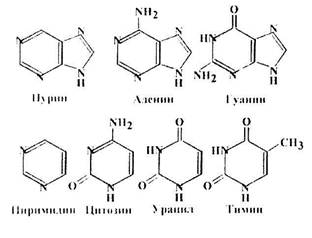 Существует два класса азотистых оснований. Пурины: аденин (А) и гуанин (Г) - содержат два гетероцикла. Пиримидины: тимин (Т), цитозин (Ц) и урацил (У) - содержат один гетероцикл.
Существует два класса азотистых оснований. Пурины: аденин (А) и гуанин (Г) - содержат два гетероцикла. Пиримидины: тимин (Т), цитозин (Ц) и урацил (У) - содержат один гетероцикл.
ФункцииДНК.
1.ДНК является носителем генетической информации.
Функция обеспечивается фактом существования генетического кода.
2. Воспроизведение и передача генетической информации в поколениях клеток и организмов.
Функция обеспечивается процессом репликации.
3. Реализация генетической информации в виде белков, а также любых других соединений, образующихся с помощью белков-ферментов.
Функция обеспечивается процессами транскрипции и трансляции.
Oтличия между ДНК и РНК.
| ДНК | РНК | |
| Сахар | Дезоксирибоза | Рибоза |
| Азотистые основания | А, Т, Г, Ц | А, У, Г, Ц |
| Количество цепей в молекуле | 99.99% двойная спираль 0.01% одноцепочечная | 99.99% одноцепочечная 0.01% двухцепочечная |
| Форма молекулы | Все одноцепочечные – кольцевые. Большинство двухцепочечных линейные, часть - кольцевые. | Линейные молекулы |
Виды РНК
| Виды РНК | Размер в нуклеотидах |
| gРНК – геномные РНК | 10000-100000 |
| mРНК – информационные (матричные) РНК | 100-100000 |
| tPHK – транспортные РНК | 70-90 |
| rPHK – рибосомные РНК | несколько дискретных классов от 100 до 500000 |
| sPHK – малые РНК | 100-300 |
Лекция 3. Структура белков.
Определение: белки - это нерегулярные полимеры, мономерами которых являются L- аминокислоты. Аминокислоты
13 природе существуют две формы стереоизомеров: L (левовращающие) и D (правовращающие). Помимо L - аминокислот, входящих в белки, в организме есть и D-аминокислоты, которые в белки не включаются.
Общая формула аминокислоты показана на рисунке.
Она верна для 19 из 20 аминокислот, встречающихся в белках. В состав белков, кроме этих 19 аминокислот, входит одна иминокислота - пролин.
Во всех аминокислотах имеется α-аминогруппа. Отсюда и название – "α -аминокислоты". В пралине – α-иминогруппа.
Классификация аминокислот, входящих в состав белков, по принципу полярности (неполярности) радикала
1. Неполярные или гидрофобные радикалы.
Алифатические - аланин, валин, лейцин, изолейцин. Серусодержащий метионин. Ароматические - фенилаланин, триптофан. Иминокислота пролин.
2. Полярные, но незаряженные радикалы. Глицин.
Оксиаминокислоты - серин, треонин, тирозин. Содержащий сульфгидрильную группу цистеин. Содержащие амидную группу: аспарагин, глутамин.
3. Отрицательно заряженные радикалы. Аспарагиновая кислота, глутаминовая кислота.
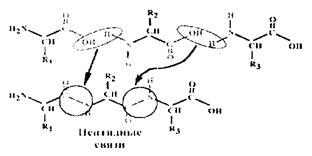 4. Положительно заряженные радикалы. Лизин, аргинин, гистидин.
4. Положительно заряженные радикалы. Лизин, аргинин, гистидин.
Первичная структура белка
Определение: первичная структура белка - это последовательность расположения аминокислотных остатков в полипептидной цепи.
Аминокислоты соединяются в полипептид с помощью ковалентных (амидных) связей.
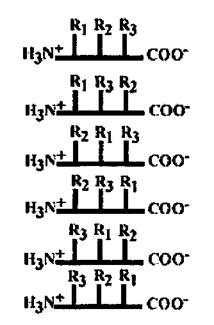 У трипептида, состоящего из трех разных аминокислот, возможно 3! = 6 различных первичных структур.
У трипептида, состоящего из трех разных аминокислот, возможно 3! = 6 различных первичных структур.
У олигопептида, состоящего из двадцати разных аминокислот, разнообразие первичных структур 20!, это □ 2х1018.
Разнообразие первичных структур среднего по размеру белка (примерно 500 аминокислот) составляет уже □ 20500 вариантов (если все аминокислоты представлены в эквимолярных соотношениях).
 На Земле не было, нет и не будет двух людей сполностью одинаковым набором белков.
На Земле не было, нет и не будет двух людей сполностью одинаковым набором белков.
Вторичная структура белка.
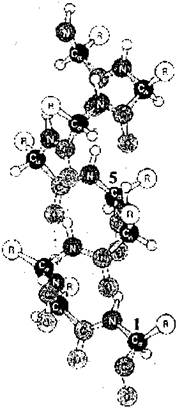
Определение: Вторичная структура белка - это упорядоченное строение полипептидных цепей, обусловленное водородными связями между группами С=О и N-H разных аминокислот.
Вторичная структура может быть регулярной (α- спиралью и нерегулярной β - складчатой структурой. В α-спирали NH группа n-ого аминокислотного остатка взаимодействует с С=О группой (п-4)-ого аминокислотного остатка. На один виток β-спирали с диаметром 10.1Å приходится 3,6 аминокислотных остатков. Период идентичности регулярной α-спирали - 18 аминокислот (5 витков). Нарушителем регулярной α-спирали в первую очередь является пролин. Второе по значению влияние оказывают одинаково заряженные, рядом расположенные радикалы.
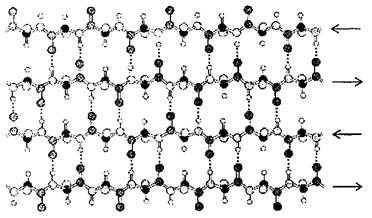 β – складки могут образовывать не только одиночные, но и рядом распо-ложенные полипептиды, вхо-дящие в один белок.
β – складки могут образовывать не только одиночные, но и рядом распо-ложенные полипептиды, вхо-дящие в один белок.
Чистых природных альфа - или бета - белков не существует.
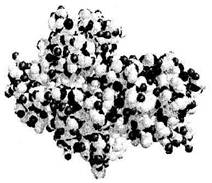
Третичная структура белка.
Определение: третичная структура белка - это пространственная кон формация полипептида, имеющего вторичную структуру, и обусловленная взаимодействиями между радикалами.
Существует четыре типа взаимодействий между радикалами:
1. Ковалентные связи между остатками двух цистеинов (дисульфидные мостики).
2. Ионные (электростатические) взаимодействия между противоположно заряженными аминокислотными остатками (три радикала со знаком "+" и два со знаком "-").
Например, положительно заряженная ε-аминогруппа лизина (-NH3+) притягивается отрицательно заряженной карбоксильной группой – (СОО-) глутаминовой или аспарагиновой кислоты.
3. Водородные связи.
 Участвуют все аминокислоты, имеющие гидроксильные, амидные или карбоксильные группы.
Участвуют все аминокислоты, имеющие гидроксильные, амидные или карбоксильные группы.
4. Гидрофобные взаимодействия. Образуются между неполярными радикалами в водной среде. Участвуют 8 аминокислот (первый класс).
Третичная структура полностью задается первичной.
Определяющими являются гидрофобные взаимодействия в силу неизбирательности (неспецифичности) и многочисленности.
Гидрофобное ядро существует у большинства белков.
Четвертичная структура белка.
Определение: четвертичная структура белка - это агрегация двух или большего числа полипептидных цепей, имеющих третичную структуру, в олигомерную функционально значимую композицию.
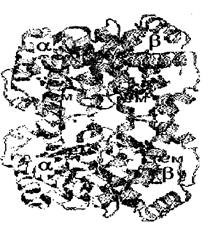 Связи, образующие и поддерживающие четвертичную структуру, те же самые, что и при образовании третичной структуры, кроме гидрофобных.
Связи, образующие и поддерживающие четвертичную структуру, те же самые, что и при образовании третичной структуры, кроме гидрофобных.
Четвертичной структурой обладает около 5% белков, в том числе гемоглобин, иммуноглобулин, инсулин. Почти все ДНК- и РНК- полимеразы имеют четвертичную структуру.
Серповидно-клеточная анемия, как пример влияния на третичную и четвертичную.
В эритроцитах содержится гемоглобин - комплекс белка глобина с небелковой железосодержащей частью - гемом.
Глобин имеет четвертичную структуру.
Он состоит из двух альфа- и двух бета- полипептидных цепей (это названия цепей, не имеющие отношения к их вторичной структуре). В сумме это 574 аминокислоты. У всех здоровых людей на 6-ом месте от N-конца в бета-цепи находится полярная глутаминовая кислота ("-" заряженная). У больных серповидно-клеточной анемией вместо нее - неполярный валин.
Из 574 аминокислот заменено 2.
Такой гемоглобин теряет растворимость, образуется волокнистый осадок, деформирующий эритроцит.
Серповидно-клеточная анемия - заболевание генетическое. Причина - замена всего одного нуклеотида в гене, кодирующем В-цепь гемоглобина. Дети -рецессивные гомозиготы по такому аллелю не доживают до двух лет. У гетерозигот 85% нормальных и 15% дефектных эритроцитов. Доминантные гомозиготы болеют малярией, гетерозиготы - не болеют.
Глобулярные и фибриллярные белки.
95% белков имеют гидрофобное ядро. 5% фибриллярные белки.
Подавляющее число глобулярных белков растворимо. Большинство фибриллярных - нерастворимо (α-кератины - на их долю приходится почти весь сухой вес волос, шерсти, рогов, копыт, ногтей, чешуи, перьев; коллаген - белок сухожилий, хрящей; фиброин - белок шелка).
Фибриллярные белки содержат большую долю заряженных аминокислоту чем глобулярные - отдельные цепи растворимы, а их комплексы неполярны и нерастворимы.
Лекция 4. Функции белков
Определение: Белок - это отдельный полипептид или агрегат нескольких полипептидов, выполняющий биологическую функцию.
Полипетид - понятие химическое. Белок - понятие биологическое.
Например, иммуноглобулин состоит из четырех полипептидных цепей, которые по отдельности не являются белками, белок - только их функциональный агрегат.
Функции белков.
1. Структурная функция.
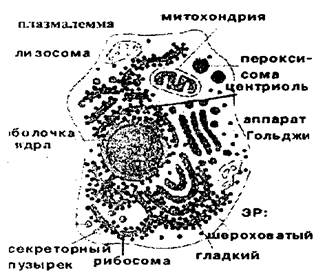 Белки входят в состав всех клеточных органелл: мембранных - плазмалемма, ядерная оболочка, эндоплазматическая или ретику-лярная сеть (ЭР), комплекс Гольджи, лизосомы, пероксисомы, вакуоль, митохондрии, пластиды - и немембранных - хромосомы, рибосомы, клеточный центр (центриоли), реснички и жгутики, микрофиламенты.
Белки входят в состав всех клеточных органелл: мембранных - плазмалемма, ядерная оболочка, эндоплазматическая или ретику-лярная сеть (ЭР), комплекс Гольджи, лизосомы, пероксисомы, вакуоль, митохондрии, пластиды - и немембранных - хромосомы, рибосомы, клеточный центр (центриоли), реснички и жгутики, микрофиламенты.
2. Каталитическая функция.
Все ферменты - белки. Эта функция в 1982 году перестала считаться уникальной. Выяснилось, что некоторые РНК тоже обладают каталитической активностью. Их называют РНКзимами.
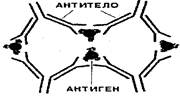 3. Защитная функция (пока уникальна).
3. Защитная функция (пока уникальна).
Антитела - это белки.
Иммуноглобулины «склеивают» антигены и образуется преципитат
4. Регуляторная функция.
На клеточном уровне: белки - репрессоры и белки – активаторы транскрипции.
На организменном уровне: некоторые гормоны - белки.
Например, инсулин - гормон поджелудочной железы. Регулирует переход глюкозы через плазмалемму. При недостаточной секреции инсулина развивается тяжелое заболевание - сахарный диабет.
Соматотропин - гормон роста. Образуется в передней доле гипофиза.
Там же образуется и адренокортикотропный гормон (АКТГ). Он действует на кору надпочечников, регулируя синтез стероидных гормонов.
5. Трансформация энергии.
Белки сетчатки глаза родопсин и ретинен трансформируют световую энергию в электрическую. Актино-миозиновые комплексы в мышцах преобразуют энергию химических связей в механическую.
6. Транспортная функция.
Гемоглобин осуществляет транспорт О2, СО2.
Трансферрин - транспорт железа.
Системы пермеаз - это мембранные белки, которые переносят полярные соединения через мембрану как по, так и против градиента концентрации.
7. Энергетическая функция.
11 из 20 аминокислот, входящих в состав белков, в организме человека "сгорают" с выделением энергии. Это - заменимые аминокислоты. Они могут быть синтезированы в клетке из продуктов расщепления углеводов и липидов.
8. Питательная функция.
а) Поставка незаменимых аминокислот. У человека 9 из 20 аминокислот не
могут быть синтезированы в организме. Они должны поступать извне.
Понятие "заменимые и незаменимые аминокислоты" видоспецифическое и касается только животных и грибов.
б) Запасные белки для развития зародыша и вскармливания младенца.
Например, казеин - белок молока, овальбумин - яичный белок, глиадин -
белок зерен пшеницы.
9. Буферная функция.
Любой белок - амфотерный полиэлектролит. Белки способствуют поддержанию определенных значений рН в разных отсеках клетки, обеспечивая этим компартментализацию.
Лекция 5. Генетический код
Определение: Генетический код - это система записи информации о последовательности расположения аминокислот в белках с помощью последовательности расположения нуклеотидов в ДНК.
Поскольку ДНК непосредственного участия в синтезе белка не принимает, то код записывается на языке РНК. В РНК вместо тимина входит урацил.
Свойства генетического кода.
1. Триплетность
Каждая аминокислота кодируется последовательностью из 3-х нуклеотидов.
 Определение: триплет или кодон - последовательность из трех нуклеотидов, кодирующая одну аминокислоту.
Определение: триплет или кодон - последовательность из трех нуклеотидов, кодирующая одну аминокислоту.
Код не может быть моноплетным, поскольку 4 (число разных нуклеотидов в ДНК) меньше 20. Код не может быть дуплетным, т.к. 16 (число сочетаний и перестановок из 4-х нуклеотидов по 2) меньше 20. Код может быть триплетным, т.к. 64 (число сочетаний и перестановок из 4-х по 3) больше 20.
2. Вырожденность.
Все аминокислоты, за исключением метионина и триптофана, кодируются более чем одним триплетом:
2 АК по 1 триплету = 2 9 АК по 2 триплета = 18 1 АК 3 триплета = 3
5 АК по 4 триплета = 20
3 АК по 6 триплетов = 18
Всего 61 триплет кодирует 20 аминокислот.
3. Наличие межгенных знаков препинания.
Определение: ген- это участок ДНК, кодирующий одну полипептидную цепь или одну молекулу tPHK, rРНК или sPHK.
Гены tPHK, rPHK, sPHK белки не кодируют.
В конце каждого гена, кодирующего полипептид, находится, по меньшей мере, один из 3-х терминирующих кодонов, или стоп-сигналов: UAA, UAG, UGA. Они терминируют трансляцию.
Условно к знакам препинания относится и кодон AUG - первый после лидерной последовательности. (См. лекцию 8) Он выполняет функцию заглавной буквы. В этой позиции он кодирует формилметионин (у прокариот).
4. Однозначность.
Каждый триплет кодирует лишь одну аминокислоту или является терминатором трансляции.
Исключение составляет кодон AUG. У прокариот в первой позиции (заглавная буква) он кодирует формилметионин, а в любой другой - метионин.
5. Компактность, или отсутствие внутригенных знаков препинания.
Внутри гена каждый нуклеотид входит в состав значащего кодона.
В 1961г. Сеймур Бензер и Френсис Крик экспериментально доказали триплетность кода и его компактность.
 Суть эксперимента: "+" мутация - вставка одного нуклеотида. "-" мутация - выпадение одного нуклеотида. Одиночная "+" или "-" мутация в начале гена портит весь ген. Двойная "+" или "-" мутация тоже портит весь ген.
Суть эксперимента: "+" мутация - вставка одного нуклеотида. "-" мутация - выпадение одного нуклеотида. Одиночная "+" или "-" мутация в начале гена портит весь ген. Двойная "+" или "-" мутация тоже портит весь ген.
Тройная "+" или "-" мутация в начале гена портит лишь его часть. Четверная "+" или "-" мутация опять портит весь ген.
Эксперимент доказывает, что код тршплетен и внутри гена нет знаков препинания. Эксперимент был проведен на двух рядом расположенных фаговых генах и показал, кроме того, наличие знаков препинания между генами.
6. Универсальность.
Генетический код един для всех живущих на Земле существ.
Это является сильнейшим свидетельством в пользу единства происхождения и эволюции.
В 1979г. Беррел открыл идеальный код митохондрий человека.
Определение: идеальным называется генетический код, в котором выполняется правило вырожденности квазидублетного кода: Если в двух триплетах совпадают первые два нуклеотида, а третьи нуклеотиды относятся к одному классу (оба - пурины или оба - пиримидины), то эти триплеты кодируют одну и ту же аминокислоту.
Из этого правила в универсальном коде есть два исключения. Оба отклонения от идеального кода в универсальном касаются принципиальных моментов: начала и конца синтеза белка:
| Кодон | Универсальный код | Митохондриальные коды | |||
| Позвоночные | Беспозвоночные | Дрожжи | Растения | ||
| UGA | STOP | Trp | Trp | Trp | STOP |
| AUA | Ile | Met | Met | Met | Ile |
| СUA | Leu | Leu | Leu | Thr | Leu |
| АGА | Arg | STOP | Ser | Arg | Arg |
| AGG | Arg | STOP | Ser | Arg | Arg |
7. Помехоустойчивость.
Определение: Мутации замен нуклеотидов, не приводящие к смене класса кодируемой аминокислоты, называют консервативными. Мутации замен нуклеотидов, приводящие к смене класса кодируемой аминокислоты, называют радикальными.
В каждом триплете можно провести 9 однократных замен. Общее количество возможных замен нуклеотидов - 61 по 9 = 549. Из них:
23 замены нуклеотидов приводят к появлению кодонов - терминаторов трансляции.
134 замены не меняют кодируемую аминокислоту.
230 замен не меняют класс кодируемой аминокислоты.
162 замены приводят к смене класса аминокислоты, т.е. являются радикальными.
Из 183 замен 3-его нуклеотида, 7 приводят к появлению терминаторов трансляции, а 176 - консервативны.
Из 183 замен 1-ого нуклеотида, 9 приводят к появлению терминаторов, 114 - консервативны и 60 - радикальны.
Из 183 замен 2-го нуклеотида, 7 приводят к появлению терминаторов, 74 - консервативны, 102 - радикальны.
Итак: 364/162=2,25 (отношение числа консервативных замен к числу радикальных замен) - показатель помехоустойчивости генетического кода.
8. Непере к рываемость.
 В 1956г. Георгий Гамов предложил вариант перекрываемого кода. Согласно Гамовскому коду, каждый нуклеотид, начиная с третьего в гене, входит в состав 3-х кодонов. Когда генетический код был расшифрован, оказалось, что он неперекрываем, т.е. каждый нуклеотид входит в состав лишь одного кодона.
В 1956г. Георгий Гамов предложил вариант перекрываемого кода. Согласно Гамовскому коду, каждый нуклеотид, начиная с третьего в гене, входит в состав 3-х кодонов. Когда генетический код был расшифрован, оказалось, что он неперекрываем, т.е. каждый нуклеотид входит в состав лишь одного кодона.
Достоинства перекрываемого генетического кода: компактность, меньшая зависимость структуры белка от вставки или делеции нуклеотида.
Недостаток: большая зависимость структуры белка от замены нуклеотида и ограничение на соседей.
В 1976г. была секвенирована ДНК фага φХ174. У него одноцепочечная кольцевая ДНК, состоящая из 5375 нуклеотидов. Было известно, что фаг кодирует 9 белков. Для 6 из них были определены гены, располагающиеся друг за другом.
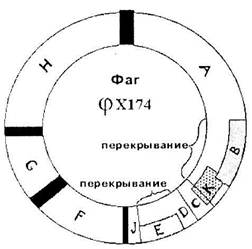 Выяснилось, что есть перекрывание. Ген Е полностью находится внутри гена D. Его инициирующий кодон появляется в результате сдвига считывания на один нуклеотид. Ген J начинается там, где кончается ген D. Инициирующий кодон гена J перекрывается с терминирующим кодоном гена D в результате сдвига на два нуклеотида. Конструкция называется "сдвиг рамки считывания" на число нуклеотидов, некратное трем. На сегодняшний день перекрывание показано только для нескольких фагов.
Выяснилось, что есть перекрывание. Ген Е полностью находится внутри гена D. Его инициирующий кодон появляется в результате сдвига считывания на один нуклеотид. Ген J начинается там, где кончается ген D. Инициирующий кодон гена J перекрывается с терминирующим кодоном гена D в результате сдвига на два нуклеотида. Конструкция называется "сдвиг рамки считывания" на число нуклеотидов, некратное трем. На сегодняшний день перекрывание показано только для нескольких фагов.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 6560; Нарушение авторских прав?; Мы поможем в написании вашей работы!