
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электронные орбиты некоторых атомов
|
|
|
|
(масштабный чертеж в соответствии с теорией Бора)
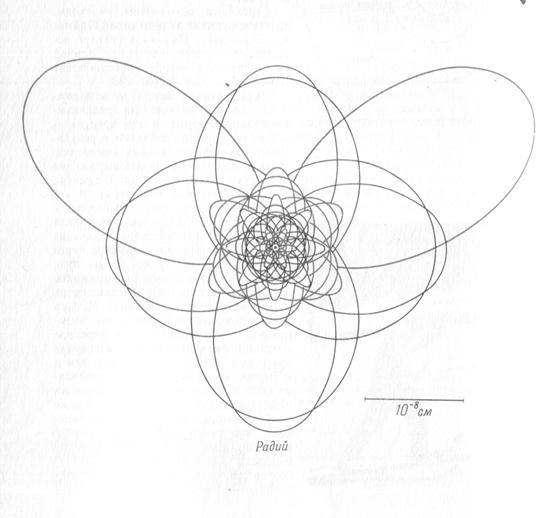
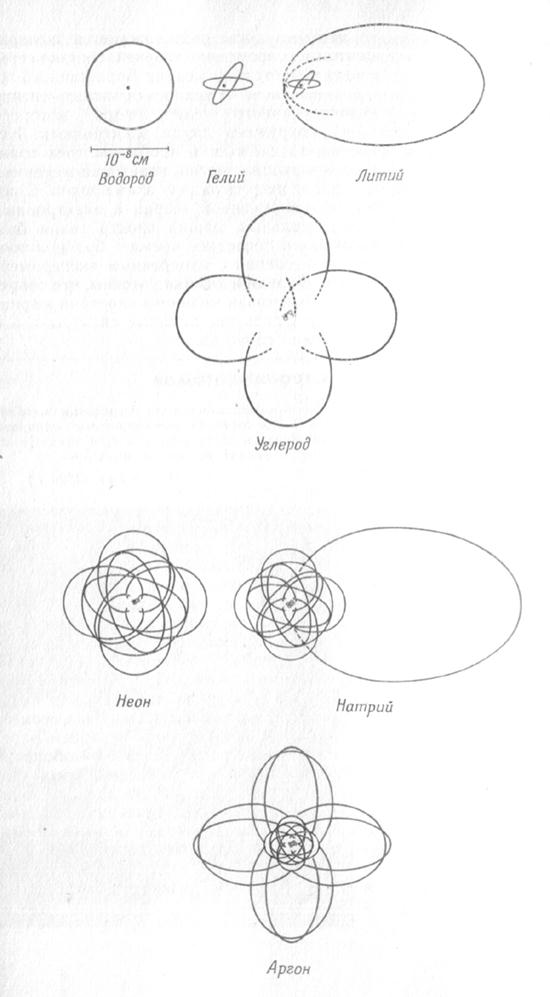
Бор использовал для описания состояния электрона законы классической механики и электростатики, которые не выполняются для движения электрона в атоме. Также не объясняет теория Бора мгновенный переход электрона с одной орбиты на другую.
Эти противоречия устранены в теории квантово-механического описания состояния атома.
Она основана на развитии представлений Эйнштейна и Планка.
Из уравнений (1) и (2) получаем 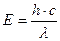 (3)
(3)
Согласно уравнению Эйнштейна энергия фотона связана с массой: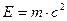 (4)
(4)
Из (3) и (4) получаем
 или
или 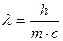 , отсюда следует, что фотону свойственна двойная природа - частицы и волны.
, отсюда следует, что фотону свойственна двойная природа - частицы и волны.
Распространение представлений о двойственности природы фотона на природу других микрообъектов, в том числе и электрона, легло в основу создания теории квантово-механического объяснения строения атома.
Де Бройль высказал предположение о двойственной природе электрона, т.е. для электрона массой m и скоростью v
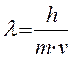 - уравнение де Бройля
- уравнение де Бройля
Наличие волновых свойств у электрона было подтверждено экспериментально.
Основываясь на двойственной природе электрона, Шрёдингер в 1925 г. предположил, что состояние движущегося в атоме электрона должно описываться известным в физике уравнением стоячей электромагнитной волны. Подставив в это уравнение вместо длины волны ее значение из уравнения де Бройля, он получил новое уравнение, связывающее энергию с пространственными координатами и так называемой волновой функцией ψ, которая в этом уравнении соответствует амплитуде трехмерного волнового процесса.
Уравнение Шрёдингера является дифференциальным уравнением в частных производных. Для стационарного состояния 1 частицы массой m:


Ĥ – Гамильтон
U – потенциальная энергия;
Е – полная энергия
h - постоянная Планка
ψ – волновая функция
х, у, z - координаты
ψ – волновая функция, ее физический смысл состоит в том, что
ψ2dv – вероятность нахождения рассматриваемой частицы в элементарном объеме dv
ψ2 - плотность вероятности или, если речь идет об электроне, - электронная плотность.
В соответствии с физическим смыслом ψ, она должна быть конечной, непрерывной и однозначной, а также обращается в ноль в тех местах пространства, где частица не может находиться, например, ψ=0 для электрона, находящегося на бесконечно большом расстоянии от ядра.
Из уравнения Шрёдингера находят Е и зависимость ψ(ψ2) от координат, т.е. распределение вероятности пребывания частицы в пространстве, в частности распределение электронной плотности в атоме.
Решение уравнения Шрёдингера приводит всегда к определенному набору дозволенных значений энергии электронов Е (квантование энергии).
Понятия квантовой механики резко отличаются от классической механики.
Квантовая механика:
определяет вероятность нахождения частицы в атоме (также массы, энергии, момента импульса).
Классическая механика:
определяет траекторию движения, координаты частицы или скорость ее движения в определенный момент времени.
Квантовая механика вместо понятия "движение электрона" использует понятие "состояние электрона", т.е. движение электрона в атоме образует "электронное облако", плотность которого в различных точках определяется плотностью вероятности ψ2 и составляет орбиталь электрона.
Одно из основных положений квантовой механики - соотношение неопределенностей Гейзенберга (1927 г.):
невозможно точно определить местоположение частицы и ее импульс
p = m·v в данный момент времени.
Δх ·Δрх ≥ћ; ћ =h/2π; ΔРх=m∙ΔVx
Δх - неопределенность положения частицы (ошибка определения ее координаты х в данный момент времени)
ΔРх, ΔVx - неопределенности составляющих импульса и скорости в направлении координаты х.
При решении уравнения Шрёдингера (для атома водорода) в полярной системе координат получают ψ в виде произведения трех функций, каждая из которых содержит только одну переменную.
ψ(r,Q,φ)=R(r)∙Q(θ)∙Φ(φ)
 |
Q – угол широты

 φ – угол долготы
φ – угол долготы
 r
r
Q



 y
y
 |
φ
 Проекция радиуса вектора
Проекция радиуса вектора
на плоскости ху
х
Наличие трех степеней свободы движения электрона приводит к тому, что в решении уравнения Шредингера для атома водорода проявляются 3 величины, которые могут принимать только целочисленные значения - три квантовых числа.
n = 1.....∞
l = 0,1,2......(n -1)
ml = 0, ±1; ±2,.... ± l
Для других (более сложных атомов) еще одно квантовое число ms =±1/2
Расчет по уравнению Шредингера позволяет определить помимо энергии электрона размер и форму электронного облака. Некоторые из форм орбиталей приведены на рисунках ниже.
z
 |

1s l = 0

 у
у
х


 z z z
z z z

 2py 2px 2рz
2py 2px 2рz
 у
у








 y у
y у
х
х х
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 473; Нарушение авторских прав?; Мы поможем в написании вашей работы!