
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Периодический закон и периодическая система. Принципы электронного строения и периодическая система элементов Д.И.Менделеева
|
|
|
|
Лекция 4
По видимости периодическому закону –
будущее не грозит разрушением, а только
надстройки и развитие обещает …
Д.И.Менделеев
Вероятно, это самый компактный и полный
значения сгусток знания, когда-либо
изобретенный человеком
Х.Шепли
Принцип исключения (Принцип Паули)
Атом не может существовать в таком квантовом состоянии, при котором два электрона данного атома имели бы одинаковый набор квантовых чисел.
Это равносильно утверждению, что два электрона могут занимать одну и ту же орбиталь лишь в том случае, если их спины противоположны.
Два электрона, с противоположными спинами, занимающие одну и ту же орбиталь, называются электронной парой или спаренными электронами (завершенная орбиталь).
Например, пусть
1) l=0, то есть s- подуровень, при этом m l =0. В этом случае имеется одна орбиталь, на которой могут находиться 2 электрона с противоположными спинами; принятое обозначение




квантовая ячейка
2) l =1, следовательно ml = 1, 0, -1, то есть имеется 3 р -орбитали, на которых могут находиться 6 электронов:
 |
3) l =2, следовательно ml = 2, 1, 0, -1, -2 то есть имеется 5 d -орбиталей, на которых могут находиться 10 электронов;
4) l =3, следовательно ml = 3, 2, 1, 0, -1, -2, -3 то есть имеется 7 f -орбиталей, на которых могут находиться 14 электронов.
Таким образом, максимально возможное количество электронов на одном подуровне равно 2(2 l +1);
максимальное количество электронов на одном электронном уровне (число электронов в атоме с одинаковым значением n ) равно 2 n2.
Обозначение орбиталей
s

 Z=1 H 1s 1
Z=1 H 1s 1


 s I период
s I период
Z=2 He 1s2 1
p


 s
s
 s 2
s 2



 Z=3 Li 1s22s 1 II период
Z=3 Li 1s22s 1 II период
Наиболее устойчивое состояние электрона в атоме соответствует минимально возможному значению его энергии, в соответствии с этим происходит заполнение электронных слоев.
Последовательность энергетических уровней в порядке возрастания энергии:
1s < 2s < 2p < 3s < 4s ≈ 3d < 4p < 5s ≈ 4d < 5p < 6s ≈ 5d ≈ 4f < 6p
Правило Хунда:
при заполнении одного подуровня наиболее устойчивому состоянию отвечает такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально.
Следовательно, для углерода





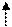

 2 s p
2 s p


 Z=6 C 1s22s22p2 1 s
Z=6 C 1s22s22p2 1 s
1 правило Клечковского: при увеличении заряда ядра атома последовательное заполнение электронных орбиталей происходит от орбиталей с меньшим значением суммы главного и орбитального квантовых чисел (n +l) к орбиталям с большим значением этой суммы,
как, например,
Z=19 K 1s22s22p63s23p64s, так как
для 3d: n =3; l =2; n +l =5, а
для 4s: n =4; l =0; n +l = 4
2 правило Клечковского: при одинаковых значениях суммы главного и орбитального квантовых чисел (n +l) заполнение орбиталей происходит последовательно в направлении возрастания главного квантового числа,
как, например,
Z=21 Sc 1s22s22p63s23p6 3d1 4s2, так как
для 3d: n =3; l =2; n +l =5
для 4р: n =4; l =1; n +l = 5
для 5s: n =5; l =0; n +l = 5
Энергетические характеристики атомов:
энергия ионизации – энергия, которую необходимо затратить для отрыва электрона от атома, находящегося в основном состоянии; измеряется в электронвольтах. Многоэлектронные атомы имеют несколько энергий ионизации I1, I2 …, соответствующих отрыву первого, второго и т.д. электронов, при этом I1 < I2 < I3 < I4 <…;
сродство к электрону – энергия, выделяющаяся при добавлении электрона к нейтральному атому, измеряется в электронвольтах.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 282; Нарушение авторских прав?; Мы поможем в написании вашей работы!