
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Направление окислительно-восстановительных процессов
|
|
|
|
Принцип Ле Шателье (1884г.) – принцип подвижного равновесия
Влияние изменения внешних условий на химическое равновесие
Если на систему, находящуюся в истинном равновесии, воздействовать извне, изменяя какое-либо из условий, определяющих истинное положение равновесия, то в системе усилится то из направлений процесса, которое ослабляет эффект этого воздействия, и положение равновесия сместится в том же направлении.
Принцип Ле Шателье справедлив для любых равновесных систем, не только химических.
Влияние температуры на равновесие
Направление смещения равновесия определяется знаком теплового эффекта реакции, а степень смещения – абсолютной величиной теплового эффекта.
∆G0Т =∆Н0- Т∆S0 = - RTlnK;
lnK=∆S0\R - ∆Н0\TR
Влияние давления на равновесие
Сжатие (повышение давления) смещает химическое равновесие в направлении процесса, сопровождающегося уменьшением объема, а уменьшение давления – в направлении процесса, сопровождающегося увеличением объема.
Степень смещения равновесия определяется знаком изменения объема системы (объемом негазообразных реагентов при этом пренебрегают), степень смещения определяется величиной изменения объема.
Влияние концентрации на равновесие
Введение в равновесную систему дополнительного количества какого-либо реагента смещает равновесие в направлении, при котором его концентрация уменьшается.
Степень смещения определяется стехиометрическими коэффициентами участвующих в реакции веществ.
∆G окислительно-восстановительного процесса можно определить экспериментально, например, при проведении его в гальваническом элементе.
Гальванический элемент (электролитическая или электрохимическая ячейка) - электрохимическая система, состоящая из электролитов и электродов, контактирующих между собой. На границе раздела фаз металл (электрод) – раствор может протекать электрохимическая реакция (электродный процесс) между компонентами этих фаз, в результате которой ионы переходят из одной фазы в другую, и на межфазной границе устанавливается разность электрических потенциалов, называется электродным потенциалом.
Электрохимическая ячейка (гальванический элемент) – устройство во внешней цепи служит для пропускания (или не пропускания) электронов во внешнюю цепь.
При погружении металла в воду или в раствор его соли, некоторое количество ионов металла, взаимодействуя с полярными молекулами воды, переходит в раствор в виде гидратированных ионов:
Металл + вода = гидратированные + электроны в кристалле
ионы металла в металла
растворе
Величину электродного потенциала металла определяют по отношению к потенциалу водородного электрода, условно принятого за ноль.
Разность потенциалов между стандартным водородным электродом и металлом, погруженным в раствор его соли с активностью ионов металла, равной 1, называют стандартным электродным потенциалом металла. (см.Приложение 1 )
Пусть есть гальванический элемент, в котором происходит реакция:
Zn(г) + CuSO4(р) = ZnSO4(р) +Cu(к)
 Zn0 -2 e Zn2+
Zn0 -2 e Zn2+
 Cu2+ +2 e Cu0
Cu2+ +2 e Cu0
Схема гальванического элемента
 |

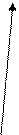



 Zn Cu электромотор
Zn Cu электромотор
 |  |  | |||
ZnSO4 CuSO4 груз


трубка с токопроводящим раствором
 |  |  |  |
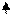

 анод Zn0 Zn2+ Cu2+ Cu0 катод
анод Zn0 Zn2+ Cu2+ Cu0 катод
 2 е
2 е
SO42-
Изменение энергии Гиббса при окислительно-восстановительных процессах служит источником э.д.с. гальванических элементов:
∆G= -nF∆E, где
n - число моль эквивалентов вещества, участвующих в реакции;
F – постоянная Фарадея (F =96485 Кл\моль);
∆E – э.д.с. элемента
∆E0 =φ0Сu - φ0Zn
φ0Сu, φ0Zn – стандартные электродные потенциалы окислителя и восстановителя, значения стандартных электродных потенциалов измеряют относительно водородного электрода, для которого φ0Н2=0 (табличные данные).
Направление окислительно-восстановительного процесса определяется знаком ∆E, если ∆E>0, то ∆G<0, реакция идет в прямом направлении.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 292; Нарушение авторских прав?; Мы поможем в написании вашей работы!