
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория электролитической диссоциации
Растворы электролитов
Электропроводность растворов электролитов объясняется диссоциацией на ионы растворенных веществ.
Удельная электропроводность – электропроводность раствора объемом 1 см3, заключенного между электродами площадью 1 см2
χ = 1\ρ, где
ρ - удельное сопротивление
Эквивалентная электропроводность:
λ = χ Vэ, где
Vэ – объем раствора, содержащего 1 моль-эквивалент растворенного вещества (разбавление раствора)
Аррениус: диссоциация молекул растворенных электролитов на ионы происходит не под действием тока, а в процессе растворения, независимо от того, пропускают через раствор электрический ток или нет.
Распад молекул электролита на ионы в среде растворителя – электролитическая диссоциация (ионизация).
Теория Аррениуса рассматривала ионы как свободные, независимые от молекул растворителя частицы. И.А.Каблуков объединил гидратную теорию Д.И.Менделеева и электролитическую теорию Аррениуса: гидратация ионов.
Степень электролитической диссоциации
Степень электролитической диссоциации α – отношение числа молекул, распавшихся на ионы к общему числу молекул растворенного вещества, т.е. доля распавшихся молекул.
Степень электролитической диссоциации равна отношению эквивалентной электропроводности при данном разбавлении раствора к эквивалентной электропроводности при бесконечном разбавлении.
α = λ\ λω
 Электролиты – вещества, растворы которых проводят электрический ток.
Электролиты – вещества, растворы которых проводят электрический ток.
Электролиты
| название | степень диссоциации,α, % | соединения |
| сильные | α>30 | соли (есть исключения), щелочи, неорганические кислоты: HCl, HI, HBr, HNO3, H2SO4, HClO4 |
| средние | 3<α<30 | щавелевая кислота (Н2С2О4), H2SO3, H3PO4 и др. |
| слабые | α<3 | основания (кроме щелочей), многие органические кислоты, H2S, HCN, H2SiO3 и др. |
Константа диссоциации
Диссоциация – обратимый процесс, поэтому для нее справедливы общие законы равновесия

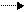 КnAm nKa+ + mAb-
КnAm nKa+ + mAb-
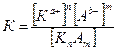 - константа диссоциации (ионизации) – справедливо для
- константа диссоциации (ионизации) – справедливо для
разбавленных растворов слабых электролитов.
В случае концентрированных растворов или растворов сильных электролитов необходимо учитывать взаимодействия частиц растворенного вещества друг с другом и с растворителем.
|
|
Дата добавления: 2014-01-06; Просмотров: 263; Нарушение авторских прав?; Мы поможем в написании вашей работы!