
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Диссоциация кислот, оснований и солей в воде
|
|
|
|
Растворы сильных электролитов
Водные растворы в неорганической химии
Задачи
1 Какова молярная концентрация эквивалента (нормальная концентрация) 0,01 М раствора Al2(SO4)3?
2. Сколько молей воды и хлористого аммония NH4Cl нужно для приготовления 200 мл раствора с массовой долей соли 25 % и плотностью 1,07 г\см3?
3. В 500 мл раствора содержится 7,1 г сульфата натрия. Найдите молярную и массовую (в г\л) концентрацию ионов Na+и SO42- в таком растворе.
Лекция 11
(продолжение)
Считай несчастным тот день или тот час,
в который ты не усвоил ничего нового и ничего не прибавил
к своему образованию
Я.А.Коменский, XVII век
Закон действия масс применим лишь к идеальным газам и идеальным растворам, опыт показывает, что этот закон применим и к разбавленным растворам слабых электролитов и неэлектролитов.
Но даже для очень разбавленных растворов сильных электролитов он не выполняется.
Поведение сильных электролитов в растворах не соответствует их полной ионизации, например, эквивалентная электропроводность растворов сильных электролитов не остается постоянной при изменении концентрации, как этого можно было бы ожидать при полной диссоциации, а увеличивается при разбавлении растворов;
что вызвано:
1) электростатическим взаимодействием ионов в растворе, которое увеличивается с ростом концентрации электролита и уменьшением расстояния между ионами;
2) сольватацией ионов, что снижает скорость их движения;
3) ассоциацией ионов (BaCl+, AgCl-2 и т.д.), что ведет к сокращению числа частиц, которое уменьшается с разбавлением.
Закон действия масс для растворов сильных электролитов выполняется, если вместо аналитической концентрации подставить активность (эффективная концентрация). – Г.Льюис, 1907 г.
Активность количественно отражает взаимодействие ионов между собой и молекулами растворителя и связана с аналитической концентрацией уравнением:
а = γ∙с
γ – коэффициент активности, характеризующий отличие свойств растворов сильных электролитов и вообще реальных растворов от идеальных.
Для предельно разбавленных растворов а = с, γ = 1.
Коэффициент активности данного иона зависит только от его заряда и от ионной силы раствора I
I =1\2 (C1Z12 + C2Z22 + …+CnZn2), где
C – концентрация иона;
Z – заряд иона
Пример. Определить ионную силу раствора, содержащего 0,1 моль\л NaCl и 0,1 моль\л ВаCl2.
NaCl ↔ Na+ + Cl-
BaCl2 ↔ Ba2+ + 2Cl-
CNa+ = 0,1моль\л; ZNa+ = 1
СВа2+ = 0,1 моль\л; ZBa2+= 2
CCl- = 0,1 + 0,2 = 0,3 моль\л; ZCl- = 1
I = 1\2∙ (0,1∙1 + 0,1∙4 +0,3∙1) = 0,4
Пользуясь табличными данными и зная Z и I, можно определить коэффициент активности.
- Кислоты – диссоциируют в воде на катион Н+(Н3О+) и анион.
Максимальное число ионов водорода, образующихся из одной молекулы кислоты, определяет ее основность.
Многоосновные кислоты диссоциируют ступенчато:
каждая ступень характеризуется константой диссоциации К, которая как любая константа равновесия не зависит от концентрации исходных веществ и продуктов реакции, т.е. есть величина постоянная для данного вещества и данной температуры.
I ступень Н3РО4↔ Н+ + Н2РО4_ 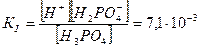
II ступень Н2РО4-↔ Н+ + НРО42- 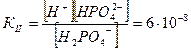
III ступень НРО42-↔ Н+ + РО43- 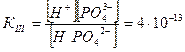
KI>KII>KIII Kд = KI∙KII∙KIII
Сила кислот (значение константы диссоциации)
Сила бескислородных кислот (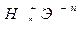 ) зависит от радиуса иона Э-n и его степени окисления, она увеличивается с ростом ионного радиуса и с уменьшением условного заряда иона n.
) зависит от радиуса иона Э-n и его степени окисления, она увеличивается с ростом ионного радиуса и с уменьшением условного заряда иона n.
Сила кислородсодержащих кислот (Э+(2m+n)Оm(OH)n) зависит от природы Э, значений m и n, она увеличивается с ростом числа атомов кислорода m и уменьшением n - числа связей О-Н, растет также с увеличением степени окисления Э.


 О = S – О – Н O = S – O - H
О = S – О – Н O = S – O - H
O – H H – O O – H
H2SO3 H2SO4
(средняя кислота) (сильная кислота)
- Основания диссоциируют в воде с образованием гидроксид-ионов ОН-.
Максимальное число гидроксид-ионов, образующееся из одной молекулы основания, определяет его кислотность.
Многокислотные основания диссоциируют ступенчато:
I ступень Cr(ОH)3↔ Cr(ОH)2 + + OН-
II ступень Cr(ОH)2 + ↔ Cr(ОH) 2+ + OН-
III ступень Cr(ОH) 2+ ↔ Cr 3+ + OН-
Амфотерные основания могут диссоциировать как по кислотному, так и по основному типу:
OH- OH-

 [Al(H2O)6]3+ Al(OH)3(H2O)3 [Al(OH)6]3-
[Al(H2O)6]3+ Al(OH)3(H2O)3 [Al(OH)6]3-


H3O+ H3O+
- Cоли при диссоциации в воде образуют катионы металлов или комплексные катионы и одноатомные или многоатомные анионы.
Кислые соли диссоциируют ступенчато:
I ступень NaHSO3 ↔ Na+ + HSO3-
II ступень HSO3- ↔ H+ + SO32-
Буферные растворы -
растворы, обладающие способностью сохранять определенное значение рН. Буферные растворы состоят из слабых кислот и оснований с их солями.
Пример. Раствор СН3СООН и СН3СООNa
СН3СООН ↔ H+ + СН3СОО- (1)
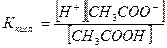
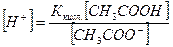
СН3СООNa ↔ Na+ + СН3СОО- (2)
В присутствии СН3СООNa равновесие (1) сдвинется влево
СН3СООН – слабый электролит, [СН3СООН] = Скисл.
СН3СООNa – сильный электролит, [СН3СОО-] = Ссоли
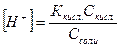
Ккисл. = const, при разбавлении 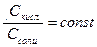 , поэтому
, поэтому
[Н+] =const
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 568; Нарушение авторских прав?; Мы поможем в написании вашей работы!