
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энтропия. Величина при равновесном изменении состояния газа есть полный дифференциал некоторой функции состояния
|
|
|
|
Величина 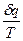 при равновесном изменении состояния газа есть полный дифференциал некоторой функции состояния. Она называется энтропия. Эта функция возникла в ходе теоретического поиска наиболее благоприятных условий превращения теплоты в работу в тепловых двигателях.
при равновесном изменении состояния газа есть полный дифференциал некоторой функции состояния. Она называется энтропия. Эта функция возникла в ходе теоретического поиска наиболее благоприятных условий превращения теплоты в работу в тепловых двигателях.
Энтропия обозначается для 1 кг газа через s и измеряется в 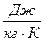 . Для произвольного количества газа энтропия, обозначаемая через S, равна
. Для произвольного количества газа энтропия, обозначаемая через S, равна 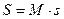 и измеряется в
и измеряется в 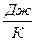 .
.
Таким образом, аналитически энтропия определяется следующим образом:
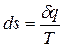 (1.12).
(1.12).
Формула справедлива для реальных и идеальных газов.
Подобно любой другой функции состояния энтропия может быть представлена в виде функции любых двух параметров состояния:
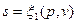 ;
; 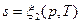 ;
; 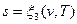 .
.
Значение энтропии для заданного состояния определяется интегрированием уравнения (1):
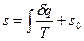 ,
,
где s0 – константа интегрирования.
Тепловая теорема Нернста: при температуре, стремящейся к абсолютному нулю, энтропия вещества, находящегося в конденсированном состоянии с упорядоченной кристаллической структурой, стремится к нулю, т.е. s0=0 при Т=0 К. Данный закон позволяет рассчитать абсолютное значение энтропии в отличие от внутренней энергии или энтальпии, которые всегда отсчитываются от произвольного уровня.
В технической термодинамике обычно используют изменение энтропии в каком либо процессе, поэтому энтропию тоже часто отсчитывают от произвольно выбранного уровня:
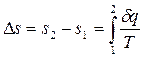 .
.
Понятие энтропии позволяет ввести чрезвычайно удобную для термодинамических расчетов T,s – диаграмму, на которой (как и на p,v –диаграмме) состояние термодинамической системы изображается точкой, а равновесный термодинамический процесс линией.
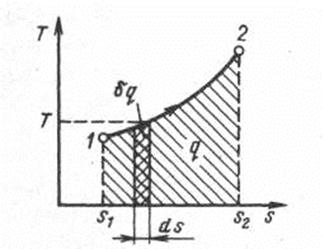
Рис. 1.6. Графическое изображение теплоты в
T,s – координатах
В равновесном процессе
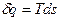 ,
,
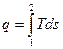 .
.
В T,s – диаграмме элементарная теплота процесса δq изображается элементарной площадкой с высотой Т и основанием ds, а площадь, ограниченная линией процесса, крайними ординатами и осью абсцисс, эквивалентна теплоте процесса. При подводе теплоты к телу (δq>0) его энтропия возрастает (δs>0), а при отводе (δq<0) его энтропия убывает (δs<0).
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 402; Нарушение авторских прав?; Мы поможем в написании вашей работы!