
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон Кирхгофа. Тепловые эффекты QV и QР являются функциями соответственно внутренней энергии и энтальпии, поэтому они
|
|
|
|
Тепловые эффекты QV и QР являются функциями соответственно внутренней энергии и энтальпии, поэтому они, очевидно, зависят от температуры и давления, а для идеальных газов – только от температуры.
Чтобы установить зависимость от температуры теплового эффекта изохорной реакции, продифференцируем по температуре уравнение
 ,
,
считая 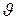 = const. Тогда
= const. Тогда
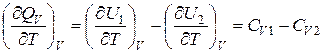 , (14.7)
, (14.7)
где СV1, CV2 – суммарные истинные теплоемкости соответственно исходных и конечных компонентов реакции.
Аналогичным образом для теплового эффекта изобарной реакции
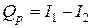
получаем
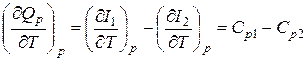 . (14.8)
. (14.8)
Полученные соотношения можно обобщить формулой
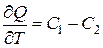 , (14.9)
, (14.9)
которая означает, что производная теплового эффекта по температуре равна разности суммарных истинных теплоемкостей исходных, и конечных компонентов реакции.
Это положение, устанавливающее зависимость теплового эффекта реакции от температуры, называется законом Кирхгофа.
Конкретные значения теплоемкостей C1 и C2 зависят от формы уравнения химической реакции. В общем виде для реакции
аА + bB +… = cC + dD +…
имеем
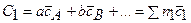 ;
;
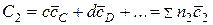 ,
,
где под n1 имеется ввиду количество киломолей каждого из исходных веществ, а под 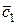 – его мольная истинная теплоемкость. Равным образом под n2 и
– его мольная истинная теплоемкость. Равным образом под n2 и 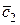 имеются в виду количество киломолей и мольная теплоемкость каждого из продуктов реакции.
имеются в виду количество киломолей и мольная теплоемкость каждого из продуктов реакции.
Для получения искомой зависимости в явном виде проинтегрируем дифференциальное уравнение
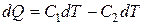 ,
,
тогда получим
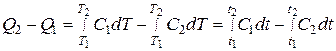
или, учитывая, что 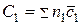 и
и 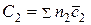 ,
,
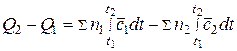 ,
,
поскольку интеграл суммы равен сумме интегралов. В соответствии с формулой (3.18)
 ,
,
поэтому
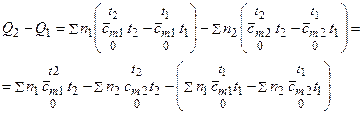
или в более общем виде
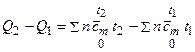 , (14.10)
, (14.10)
где под n имеется в виду число киломолей каждого из компонентов реакции, положительное для исходных веществ и отрицательное для конечных продуктов реакции. Равным образом, под  имеется в виду средняя мольная теплоемкость каждого из компонентов реакции.
имеется в виду средняя мольная теплоемкость каждого из компонентов реакции.
Естественно, что из таблиц следует брать значения теплоемкостей 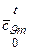 или
или 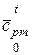 в зависимости от того, идет ли речь о тепловых эффектах изохорных или изобарных реакций.
в зависимости от того, идет ли речь о тепловых эффектах изохорных или изобарных реакций.
Экспериментальные данные по тепловым эффектам химических реакций обычно приводятся к стандартным условиям – давлению 760 мм.рт. ст. и температуре 25 °С. Зная стандартный тепловой эффект реакции Q0, значение его при любой другой температуре t может быть найдено по формуле
 . (14.11)
. (14.11)
Возможность определения теплового эффекта реакции при любой температуре по известному стандартному тепловому эффекту этой же реакции и определяет практическую значимость закона Кирхгофа.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 324; Нарушение авторских прав?; Мы поможем в написании вашей работы!