
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Скорость химической реакции и закон действующих масс
|
|
|
|
Интенсивность протекания химической реакции принято характеризовать величиной изменения концентрации какого-либо из ее компонентов в единицу времени. Величина этого изменения концентрации называется скоростью химической реакции. Скорость реакции в общем случае не остается постоянной во времени, в связи с чем приходится ввести понятие о средней скорости химической реакции. Средней скоростью реакция
aA+bB+...= cC+dD+...
за промежуток времени Δτ называется отношение изменения концентрации одного из компонентов, например компонента А, к этому промежутку времени
 . (14.12)
. (14.12)
Если речь идет о скорости реакции в данный то это отношение превращается в производную концентрации по времени
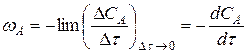 . (14.13)
. (14.13)
В обоих случаях выражение для скорости реакции отрицательно, потому что в ходе реакции концентрация исходного вещества А уменьшается, т. е. ее приращение отрицательно, а промежуток времени, к которому оно отнесено, положителен. В то же время скорость реакции представляет собой по смыслу величину положительную.
Если скорость реакции отнести к одному из конечных веществ (например, к компоненту D), то минус будет отсутствовать, ибо концентрация этого компонента в ходе реакции увеличивается
 .
.
Нетрудно заметить, что скорости одной и той же реакции, взятые применительно к различным компонентам, в общем случае не одинаковы, но пропорциональны друг другу, ибо компоненты реакции расходуются и образуются в эквивалентных количествах. Например, в приведенной выше реакции при расходовании а киломолей вещества А образуется d киломолей вещества D, следовательно,
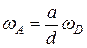
и т.д.
В основе учения о скоростях химических реакций лежит закон действующих масс, гласящий, что скорость реакции в каждый момент времени пропорциональна произведению концентраций реагирующих веществ. Этот закон легко обосновать исходя из тех соображений, что для совершения каждой элементарной реакции молекулы должны столкнуться и частота таких столкновений определяет скорость реакции. Очевидно, что эта частота пропорциональна числу молекул каждого из реагентов, т.е. пропорциональна произведению их концентраций.
Для реакции А + В = С + D закон действующих масс дает
 ,
,
где k – коэффициент пропорциональности, называемый константой скорости.
Для более сложной реакции, когда реагенты вступают во взаимодействие в различных мольных количествах,
aA+bB+...= cC+dD+..
в выражение для скорости реакции концентрация реагента А должна войти, очевидно, а раз, концентрация реагента вещества B - b раз и т.д., т.е.

Вышеуказанные зависимости справедливы лишь в тех случаях, когда все реагенты находятся в газовой фазе. Если же в реакции участвуют твердые или жидкие вещества, то изменение их не сказывается на скорости реакции и поэтому в формулу для нее эти концентрации не входят. Так, например, для реакции горения углерода
С + О2 = СО2
скорость реакции определяется из формулы, в которую концентрация углерода не входит
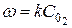 .
.
В то же время для реакции горения водорода
2Н2 + О2 = 2Н2О
в выражение скорости реакции входят концентрации обоих исходных веществ
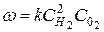 .
.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 393; Нарушение авторских прав?; Мы поможем в написании вашей работы!