
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Степень диссоциации и ее связь с константой равновесия
|
|
|
|
Диссоциацией называется реакция разложения химически сложного вещества на более простые, которая может возникнуть, если изменятся условия, в которых находится исходное вещество (т. е. его давление или температура). Начавшись, диссоциация продолжается до тех пор, пока между исходным веществом и ее продуктами не установится химическое равновесие, соответствующее новым условиям. После этого видимое течение реакции прекращается.
Глубина реакции может быть различной в зависимости от давления и температуры равновесной смеси исходного вещества с продуктами диссоциации. Ее принято характеризовать степенью диссоциации, обозначаемой буквой α, которая представляет собой ту долю исходного вещества, которая разложилась к моменту достижения равновесия.
Очевидно, что для процесса диссоциации, характеризуемого уравнением
аА ↔ bB + cC +…,
константа равновесия 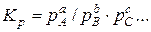 и степень диссоциации α связаны между собой зависимостью КР = f (α), причем эта зависимость обратна в том смысле, что с увеличением степени диссоциации константа равновесия уменьшается, и наоборот.
и степень диссоциации α связаны между собой зависимостью КР = f (α), причем эта зависимость обратна в том смысле, что с увеличением степени диссоциации константа равновесия уменьшается, и наоборот.
Величина константы равновесия всякой реакции зависит от давления (а также и от температуры, но эта последняя зависимость рассматривается не здесь, а в § 14.14). При этом связь между константой равновесия и давлением выражается простой формулой
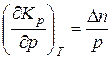 , (14.17)
, (14.17)
где Δn – изменение числа киломолей в ходе реакции.
Применяя эту формулу к реакциям диссоциации, можно видеть, что в зависимости от изменения числа киломолей последние делятся на три группы: реакции, идущие с увеличением числа киломолей (Δn >0), у которых с ростом давления константа равновесия увеличивается, следовательно, степень диссоциации уменьшается; реакции, идущие с уменьшением числа киломолей (Δn < 0), у которых с ростом давления константа равновесия уменьшается, следовательно, степень диссоциации увеличивается, наконец, реакции, идущие без изменения числа киломолей, у которых ни константа равновесия, ни степень диссоциации от давления не зависят.
Зависимость KР = f(α) для каждой конкретной реакции имеет свою форму, вытекающую непосредственно из уравнения реакции. В качестве примера рассмотрим диссоциацию двуокиси углерода по уравнению
2СО2 ↔ 2СО+О2,
относящуюся к реакциям первой группы (Δn >0).
Обозначая степень диссоциации СО2 через α, получаем, что к моменту равновесия из двух киломолей СО2 останется 2(1– α) киломолей, причем образуется 2 α киломолей СО и α киломолей О2. Таким образом, при равновесии смесь будет содержать nсм =2(1 – α)+2 α + α =2+ α киломолей вместо двух киломолей в начале реакции.
Соответственно парциальные давления компонентов смеси сос-ставят при общем давлении смеси рсм.
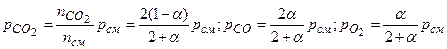 .
.
Тогда выражение для КР принимает вид
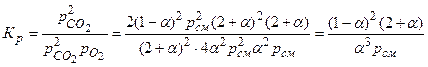 .
.
Полученное выражение и является искомой зависимостью KР = f(α). Аналогичным методом можно составить уравнение связи между константой равновесия и степенью диссоциации для реакций второй или третьей группы.
Иногда в уравнении диссоциации исходное вещество помещается не слева, а справа, т. е. диссоциация выражается уравнением bB + +cC+…↔aA. В таких случаях константа равновесия выражается обратной формулой
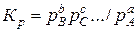 ,
,
а поэтому зависимость между ней и степенью диссоциации становится прямой в том смысле, что с увеличением степени диссоциации константа равновесия также увеличивается.
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 5424; Нарушение авторских прав?; Мы поможем в написании вашей работы!