
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термодинамические условия равновесия химических реакций
|
|
|
|
Ранее было показано, что общим условием равновесия термодинамической системы является максимальное значение ее энтропии, математическим выражением которого являются соотношения
ds = 0 и d2s < 0.
В некоторых случаях, в частности для химических реакций, это условие может быть выражено и через другие функции состояния системы.
Так, объединенное аналитическое выражение первого и второго законов термодинамики для системы, в которой не совершается полезная работа,
TdS ≥ dU + pdV
или
dU -TdS + pdV ≤ 0
для изохорно-изотермических реакций, протекающих без совершения полезной работы, при V = const и T = const принимает вид:
dU - TdS ≤ 0
или в конечной форме
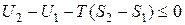 . (14.18)
. (14.18)
Этому выражению можно придать другой вид
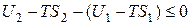 .
.
Величина U –TS, являющаяся функцией состояния, поскольку все входящие в нее величины зависят только от состояния системы, называется свободной энергией и обозначается буквой F. Смысл этого названия будет виден из дальнейшего.
Таким образом,
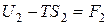 и
и 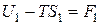 ,
,
следовательно, для изохорно – изотермических систем получаем
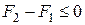 , (14.19)
, (14.19)
где знак равенства относится к обратимым, а знак неравенства – к необратимым изменениям системы.
Полученное соотношение показывает, что при обратимых изменениях изохорно-изотермических систем их свободная энергия остается без изменения, а при необратимых – уменьшается.
Это означает, что равновесие таких систем, создающееся в результате термодинамически необратимых изменений в них, наступает при достижении их свободной энергией минимума, когда
dF = 0 и d2F > 0. (14.20)
Полученные соотношения и выражают аналитическое равновесие изохорно– изотермических систем.
Аналогично этому общее уравнение
dU – TdS + pdV ≤ 0
для изобарно – изотермических реакций, протекающих при p = const и
Т = const, в конечной форме примет вид
 , (14.21)
, (14.21)
или
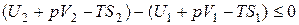 ,
,
или, наконец,
 , (14.22)
, (14.22)
где I – энтальпия системы.
Функция состояния I – TS называется изобарным потенциалом и обозначается через Z. Таким образом,
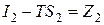 и
и  ,
,
следовательно, для изобарно – изотермических систем получаем
Z2 – Z1 ≤ 0, (14.23)
т. е. при обратимых изменениях изобарно-изотермических систем их изобарный потенциал остается без изменения, а при необратимых изменениях – уменьшается.
Это означает, что равновесие изобарно-изотермических систем, создающееся в результате необратимых изменений в ней, наступает при минимальном значении изобарного потенциала и аналитически условие этого равновесия выражается соотношениями
dZ = 0 и d2Z > 0. (14.24)
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 511; Нарушение авторских прав?; Мы поможем в написании вашей работы!