
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Количественное определение. Доброкачественность
|
|
|
|
Доброкачественность
Подлинность
Получение
MgO: 1) Получают обработкой природных рассолов известковым молоком - Ca(OH)2:
MgCl2 + Ca(OH)2 → Mg(OH)2↓ + CaCl2
При прокаливании при 500о С магния гидроксид образует оксид:
Mg(OH)2 → MgO + H2O
2) Другим способом можно получить препарат прокаливанием основного карбоната магния: 3 MgCO3 ∙ Mg(OH)2 ∙ 3 H2O → 4 MgO + 3 CO2 ↑ + 4 H2O
MgSO4: получают из магнезита: MgCO3 + H2SO4 → MgSO4 + CO2 ↑ + H2O
Для проведения реакций подлинности магния оксид растворяют в разведенных кислотах:
MgO + 2 HCl → MgCl2 + H2O
Качественный анализ соединений магний заключается в подтверждении магний-иона и соответствующего аниона соли.
Mg2+: 1) MgCl2 + Na2HPO4 + NH4OH + NH4Cl → MgNH4PO4 ↓ + 2 NaCl + H2O
белый
NH4Cl добавляют чтобы не образовывался аморфный осадок Mg(OH)2, однако избыток NH4Cl препятствует образованию осадка фосфата магния аммония.
2) Препарат с 8-оксихинолином в присутствии аммиачного буфера образует желто-зеленый осадок.
SO42-: MgSO4 + BaCl2 → BaSO4 ↓ + MgCl2
белый
В природных минералах магний сопровождается другими элементами: Ca2+, Ba2+, а также Fe.
MgO: допустимы: Cl-, SO42-, Ca2+, т.м., Fe, As;
· карбонаты щелочных металлов определяют после нагревания раствора препарата. Затем фильтрат титруют 0,05 н раствором HCl по фенолфталеину; должно уйти не более 1,3 мл титранта.
· растворимые соли определяют выпариванием фильтрата. Остаток д.б. не более 1,25 %.
MgSO4: допустимы: Cl-, т.м., Fe, As;
· Mn2+: к препарату + H2SO4 к. + 0,1 н AgNO3 (катализатор) и кипятят. Далее добавляют персульфат аммония и продолжают кипятить. Параллельно ставят контрольный опыт с 0,01 н KMnO4 и H2SO4 к. Сравнивают окраску на белом фоне по оси пробирок.
В испытуемом растворе: Mn2+ + (NH4)2S2O8 + H2SO4 к. → HMnO4 + (NH4)2SO4
В контрольном опыте: H2O + 2 KMnO4 + H2SO4 к. → 2 HMnO4 + K2SO4
В препарате допускается примеси марганца не более 0,0004 %. В инъекционных растворах примесь марганца не допускается.
1) Комплексонометрия. Метод основан на образовании прочных, растворимых в воде комплексов ионов магния с титрованным раствором трилона Б – динатриевой солью этилендиаминтетрауксусной кислоты.

 CH2COONa CH2COONa
CH2COONa CH2COONa

 CH2− N CH2− N
CH2− N CH2− N

 CH2COOH CH2COO
CH2COOH CH2COO
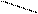


 CH2COOH + MgSO4 → CH2COO Mg + Н2SO4
CH2COOH + MgSO4 → CH2COO Mg + Н2SO4

 CH2− N CH2− N
CH2− N CH2− N
CH2COONa CH2COONa
Э = М/2.
Индикатор КХТС или КХЧС. Из этих индикаторов КХЧС более чувствительный, но он неустойчив в растворах, поэтому его чаще применяют в виде кристаллов в смеси с NaCl 1:100. КХТС более устойчив в растворах, а по чувствительности не уступает КХЧС. Индикаторы взаимодействуют с Mg2+ при pH 9-10. Так как при титровании выделяется H2SO4, то pH раствора может сдвинуться, поэтому и необходимо добавлять аммиачный буфер до pH 7-11.
Титрование прямое. После прибавления индикатора КХЧС, сначала образуется менее прочное соединение Mg ∙ Ind красно-фиолетового цвета окрашивание, затем при титровании образуется более прочный комплекс Mg · Тр.Б, а в точке эквивалентности свободный индикатор окрасит раствор в синий цвет. Mg2+ + HInd → Mg · Ind + H+
Mg2+ + Тр.Б → Тр.Б . Mg + 2 H+
В точке эквивалентности: Mg · Ind + Тр.Б → Тр.Б . Mg + HInd
КХЧС: 1-[(1′гидроксил-2′-нафтил)-азо]-6-нитро-2-нафтол-4-сульфокислоты натриевая соль
синее красно-фиолетовое
окрашивание окрашивание
2) Гравиметрия. Препарат осаждают Na2HPO4 или 8-оксихинолином, осадок сушат, прокаливают и взвешивают.
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 1062; Нарушение авторских прав?; Мы поможем в написании вашей работы!