
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кислотно-основное титрование (метод нейтрализации)
|
|
|
|
Меркуриметрия
Аргентометрия
Осадительное титрование
Титриметрические (объемные) методы
Отличаются значительно меньшей трудоемкостью, чем гравиметрический метод, и достаточно высокой точностью.
Метод основан на использовании реакций осаждения или образования малодиссоциированных соединений.
Метод основан на реакциях осаждения галогенидов раствором нитрата серебра.
KCI + AgNO3 → AgCI ↓ + KNO3 Э = М.м.
Прямое титрование: Метод Мора: среда нейтральная, индикатор - хромат калия, определяют Cl - и Br - . Метод Фаянса: среда уксуснокислая, индикатор - флуоресцеин (Cl-) и эозинат натрия (I-, Br -).
Обратное титрование (роданометрия, тиоцианометрия): Метод Фольгарда: среда азотнокислая, индикатор - железоаммониевые квасцы, титранты - AgNO3 и NH4CNS, в точке эквивалентности появляется красное окрашивание. Косвенный метод Фольгарда: сначала после добавления 0,1 мл 0,1 М раствора NH4CNS появляется красное окрашивание от взаимодействия с индикатором, а затем титруют раствором AgNO3 до обесцвечивания.
Аргентометрически определяют галогениды щелочных металлов, четвертичных аммониевых оснований, соли галогеноводородных кислот органических оснований, сульфамидов.
Например: сульфаниламиды образуют соли серебра в виде белого осадка.
Аргентометрический метод отличается высокой чувствительностью, правильностью и воспроизводимостью, прост в исполнении. Однако значительный расход дорогостоящего серебра настоятельно требует его замены.
Метод основан на образовании слабодиссоциированных соединений ртути (II).
Точку эквивалентности устанавливают потенциометрически или с помощью индикаторов – дифенилкарбазида или дифенилкарбазона, которые образуют с избытком ионов ртути (II) окрашенные в красно-фиолетовый цвет соединения.
При анализе йодидов возможен безиндикаторный метод.
2KI + Hg(NO3)2 → HgI2 ↓ + 2KNO3 (красный осадок)
HgI2 + 2 KI → K2HgI4 (бесцветный)
K2HgI4 + Hg(NO3)2 → 2HgI2↓ + 2KNO3 (красный осадок)
Э= 2 М.м. Титруют до устойчивой красной мути.
Это методы количественного определения лекарственных веществ, обладающих кислотными и основными свойствами в водной или неводной среде.
Растворимые в воде вещества, обладающие кислыми свойствами, титруют сильными основаниями (алкалиметрия), а вещества основного характера – растворами сильных кислот (ацидиметрия). Наиболее часто используют при титровании индикаторы: метиловый оранжевый, метиловый красный, бромтимоловый синий, фенолфталеин, тимолфталеин.
| Ацидиметрия | Алкалиметрия |
| Водная среда | |
| Прямое титрование Титруют хлористоводородной кислотой натриевые соли неорганических кислот. Например: NaHCO3 + HCl → NaCl + CO2↑ + H2O Э=М.м. | Прямое титрование Титруют неорганические кислоты, вещества гетероциклической структуры, содержащие в молекуле группу –COOH. Например: HCl + NaOH → NaCl + H2O Э=М.м. |
Обратное титрование
(сочетание с гидролизом)
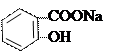  Лекарственные вещества, представляющие собой сложные эфиры или амиды предварительно гидролизуют раствором щелочи, избыток которого затем оттитровывают кислотой.
+2NaOH →
+ СН3СООNa + Н2О
NaOH + HCl → NaCl + H2O
избыток
Параллельно проводят контрольный опыт. Лекарственные вещества, представляющие собой сложные эфиры или амиды предварительно гидролизуют раствором щелочи, избыток которого затем оттитровывают кислотой.
+2NaOH →
+ СН3СООNa + Н2О
NaOH + HCl → NaCl + H2O
избыток
Параллельно проводят контрольный опыт.
| Обратное титрование (сочетание с гидролизом) Гидролиз сложных эфиров или амидов обычно выполняют титрованным раствором кислоты, а избыток её оттитровывают щелочью (например, уротропин). Параллельно проводят контрольный опыт. |
| Косвенное определение Алкалоиды теобромина и теофиллина осаждают ионами серебра, при этом выделяется эквивалентное количество азотной кислоты, которую оттитровывают щелочью. \ \ N-H + AgNO3 → N-Ag ↓ + HNO3 ∕ ∕ HNO3 + NaOH → NaNO3+ H2O | |
| Титрование в смешанных растворителях | |
| Иногда органическое основание извлекают хлороформом или эфиром, растворитель отгоняют и титруют основание ацидиметрическим методом. \ \ N − + HCI → N − . HCI ∕ ∕ | Смешанные растворители состоят из воды и органических растворителей. Их применяют, когда препарат плохо растворим в воде или водные растворы имеют слабовыраженные кислотные или щелочные свойства. Например: салициловая кислота растворяется в спирте и титруется водным раствором NaOH. Некоторые лекарственные вещества при растворении в смешанных растворителях изменяют кислотно-основные свойства. Например: борная кислота при растворении в смеси воды и глицерина усиливает кислотные свойства вследствие образования одноосновной диглицериноборной кислоты. Смешанные растворители (спирт + вода или ацетон + вода) используют для алкалиметрического титрования сульфаниламидов. Несмешивающиеся растворители (вода + хлороформ) используют при количественном определении солей органических оснований (например, алкалоиды, новокаин). Хлороформ извлекает из водной фазы органическое основание, выделяющееся при титровании щелочью. \ \ N − . HCI + NaOH → N − ↓ + NaCI + Н2О ∕ ∕ |
| Оксимный метод Основан на нейтрализации эквивалентного количества хлористоводородной кислоты, выделившейся в результате взаимодействия гидроксиламина гидрохлорида с кетопроизводными (например, камфорой): \ \ С=O+NH2OH·HCl → C=N-OH↓ + HCl +H2O ∕ ∕ HCl + NaOH → NaCl + H2O | |
| Титрование в среде неводных растворителей (неводное титрование) | |
| Обратное титрование (сочетание с этерификацией) Некоторые спирты и фенолы например, (глицерин, синэстрол) ацетилируют в неводной среде уксусным ангидридом. Затем избыток уксусного ангидрида, нагревая с водой, превращают в уксусную кислоту, которую титруют щелочью. 2R-OH + (CH3CO)2O → 2R- O - C -CH3 + H2O ║ O (CH3CO)2O изб. + H2O → 2CH3COOH 2CH3COOH +2NaOH→ 2CH3COONa+2 Н2О Параллельно проводят контрольный опыт. | |
| Органические основания и их соли (например: кофеин, фтивазид) проявляют слабые основные свойства, поэтому титрование выполняют, используя в качестве растворителя безводную уксусную кислоту или уксусный ангидрид. Титрант – раствор хлорной кислоты в безводной уксусной кислоте. Индикатор – кристаллический фиолетовый в безводной уксусной кислоте. Слабое органическое основание при рас- творении в безводной уксусной кислоте становится более сильным основанием: R3N + CH3COOH → R3N+− H + CH3COO- При приготовлении титранта образуются перхлорат-ион и ион ацетония: CH3COOH + HClO4 → ClO4- + CH3COOH2+ При титровании: CH3COO- + CH3COOH2+→ 2 CH3COOH, а R3N+− H + ClO4-→ [ R3N+− H ] ClO4- Галогениды четвертичных аммониевых оснований и соли галогеноводородных кислот нельзя точно оттитровать в неводной среде, так как галоген-ионы проявляют кислые свойства даже в среде безводной уксусной кислоты. Поэтому их титруют в присутствии (CH3COO)2Hg (можно взять смесь муравьиной кислоты с уксусным ангидридом 1:20), при этом галоген-ионы связываются в малодиссоциированные соединения. Примеры димедрол, дибазол, промедол, эфедрина гидрохлорид. | Органические вещества, проявляющие слабые кислые свойства (например: фенолы, барбитураты, сульфаниламиды) титруют, используя в качестве растворителя ДМФ. Титрант – раствор NaOH в CH3OH или раствор метилата натрия. Индикатор – тимоловый синий. H | + R−OH + H−C−N−CH3 → R−O- + H−C−N−CH3 ║ | ║ | O CH3 O CH3 R−O- + CH3ONa → R−ONa + CH3O – H | + CH3O- + H−C−N−CH3 → CH3OH + H−C−N−CH3 ║ | ║ | O CH3 O CH3 Недостатком неводного титрования является необходимость герметизированной титровальной установки. Работа ведется с весьма токсичными летучими растворителями. |
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 602; Нарушение авторских прав?; Мы поможем в написании вашей работы!