
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Следствия закона Гесса
|
|
|
|
Из закона Гесса вытекает несколько важных следствий. Рассмотрим некоторые из них.
Следствие 1: теплота, выделяющаяся при образовании вещества, равна теплоте, поглощаемой при разложении такого же его количества на исходные составные части (иначе это закон Лавуазье-Лапласа). Это означает, что, например, для реакций
СаСО3, т = СаОт + СО2, г, D Н 1;
СаОт + СО2, г = СаСО3, т, D Н 2
при одинаковых температурах будет выполняться соотношение
D Н 1 = – D Н 2.
Следствие 2: энтальпия химической реакции равна сумме энтальпий образования продуктов реакции минус сумма энтальпий образования исходных веществ с учетом стехиометрических коэффициентов в уравнении реакции.
Для реакции общего вида
a A + b B = d D + f F
данное следствие означает
D Н = d D Н  (D) + f D Н
(D) + f D Н  (F) – a D Н
(F) – a D Н  (A) – b D Н
(A) – b D Н  (B).
(B).
Энтальпией образования вещества D Н  называют изменение энтальпии реакции образования 1 моль данного вещества из простых веществ. Если энтальпия образования вещества определена при стандартных условиях, то ее называют стандартная энтальпия образования вещества и обозначают D Н
называют изменение энтальпии реакции образования 1 моль данного вещества из простых веществ. Если энтальпия образования вещества определена при стандартных условиях, то ее называют стандартная энтальпия образования вещества и обозначают D Н  .
.
Для большинства веществ D Н  определены и приводятся в справочной литературе. Стандартные энтальпии образования простых веществ, устойчивых при стандартных условиях, приняты равными нулю. Например, устойчивой модификацией углерода при стандартных условиях является графит, а неустойчивой - алмаз, поэтому
определены и приводятся в справочной литературе. Стандартные энтальпии образования простых веществ, устойчивых при стандартных условиях, приняты равными нулю. Например, устойчивой модификацией углерода при стандартных условиях является графит, а неустойчивой - алмаз, поэтому
D Н  (Сграфит) = 0, а D Н
(Сграфит) = 0, а D Н  (Салмаз) = 1,9
(Салмаз) = 1,9 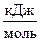 .
.
Следствие 3: энтальпия химической реакции равна сумме энтальпий сгорания исходных веществ минус сумма энтальпий сгорания продуктов реакции с учетом стехиометрических коэффициентов в уравнении реакции.
Или математически для реакции вида a A + b B = d D + f F
D Н = a D Н 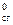 (A) + b D Н
(A) + b D Н 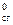 (B) – d D Н
(B) – d D Н 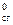 (D) – f D Н
(D) – f D Н 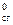 (F).
(F).
Энтальпией сгорания вещества D Н 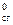 называют изменение энтальпии реакции окисления кислородом элементов, входящих в состав вещества, до образования высших оксидов. Значения энтальпий сгорания веществ имеются в справочной литературе. D Н
называют изменение энтальпии реакции окисления кислородом элементов, входящих в состав вещества, до образования высших оксидов. Значения энтальпий сгорания веществ имеются в справочной литературе. D Н 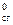 для высших оксидов равно нулю.
для высших оксидов равно нулю.
С помощью термохимических расчетов можно определить энергетические эффекты многих процессов: энергию образования химической связи, энергию кристаллической решетки, энергию межмолекулярного взаимодействия, энтальпию растворения и сольватации, энтальпию фазовых переходов и т.д.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 611; Нарушение авторских прав?; Мы поможем в написании вашей работы!