
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Направление протекания химических реакций
|
|
|
|
Самопроизвольному протеканию химических процессов в изобарно-изотермических условиях способствуют уменьшение энтальпии и увеличение энтропии системы. Первая тенденция характеризуется энтальпийным фактором и выражается через D Н, а вторая - характеризуется энтропийным фактором и количественно выражается через T× D S.
Совместное влияние энтальпийного и энтропийного факторов учитывает изменение энергии Гиббса D G (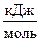 )
)
D G = D Н - T× D S,
где Т - абсолютная температура, К.
Самопроизвольно при Р,Т = const в прямом направлении могут протекать реакции, для которых D G < 0. Если D G реакции больше нуля, то такой процесс может протекать самопроизвольно только в обратном направлении. Реакции, имеющие D G = 0, находятся в состоянии равновесия, то есть для них равновероятно прямое и обратное течение процесса.
Расчет изменения энергии Гиббса реакции в стандартных условиях D G 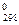 можно осуществить двумя способами:
можно осуществить двумя способами:
1. По уравнению D G 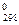 = D Н
= D Н 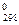 - Т× D S
- Т× D S 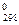 . Расчет D Н
. Расчет D Н 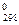 и D S
и D S 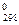 подробно рассмотрен ранее.
подробно рассмотрен ранее.
2. По формуле, аналогичной при расчете D Н 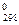 реакции через энтальпии образования участников реакции. В этом случае для реакции вида
реакции через энтальпии образования участников реакции. В этом случае для реакции вида
a A + b B = d D + f F
D G 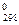 = d D G
= d D G  (D) + f D G
(D) + f D G  (F) - a D G
(F) - a D G  (A) - b D G
(A) - b D G  (B),
(B),
где D G  - стандартная энергия Гиббса образования вещества,
- стандартная энергия Гиббса образования вещества, 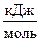 .
.
Стандартной энергией Гиббса образования вещества D G  называют изменение энергии Гиббса реакции образования 1 моль соединения из простых веществ, находящихся в стандартных условиях. D G
называют изменение энергии Гиббса реакции образования 1 моль соединения из простых веществ, находящихся в стандартных условиях. D G  простых веществ равны нулю, а для сложных веществ - определены и содержаться в справочной литературе.
простых веществ равны нулю, а для сложных веществ - определены и содержаться в справочной литературе.
Направление химической реакции, прежде всего, определяется ее природой. Так, для экзотермических реакций (D Н < 0), сопровождающихся возрастанием числа моль газообразных веществ (D S > 0), при любой температуре изменение энергии Гиббса будет отрицательным. То есть независимо от температуры такие реакции могут протекать только в прямом направлении. Наоборот, эндотермические реакции (D Н > 0), сопровождающихся уменьшением числа моль газообразных веществ (D S < 0), независимо от значения температуры в системе могут протекать только в обратном направлении, так как в этом случае D G всегда положительное.
При сочетании D Н > 0, D S > 0 или D Н < 0, D S < 0 возможность протекания реакции в прямом направлении будет зависеть от температуры. При невысоких температурах 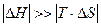 , поэтому энтальпийный фактор вносит больший вклад в значение D G. При высоких температурах, когда
, поэтому энтальпийный фактор вносит больший вклад в значение D G. При высоких температурах, когда 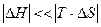 , знак D G будет определяться знаком энтропийного фактора.
, знак D G будет определяться знаком энтропийного фактора.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 2476; Нарушение авторских прав?; Мы поможем в написании вашей работы!