
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Первый закон химической термодинамики. Первый закон термодинамики представляет собой в наиболее общем виде закон сохранения энергии для систем
|
|
|
|
Первый закон термодинамики представляет собой в наиболее общем виде закон сохранения энергии для систем, в которых изменение энергии происходит в виде теплоты и работы.
Для любого процесса соблюдается равенство: Q = ΔU + A
Формулировка 1-ого закона химической термодинамики: теплота, подведённая к системе, расходуется на изменение внутренней энергии и совершение работы:
Q = ΔU + A, (1.3)
где Q – теплота, Дж
ΔU – изменение внутренней энергии, Дж
А – работа, Дж.
U – внутренняя энергия. Внутренней энергией называется сумма кинетической энергии движения частей системы и потенциальной энергии их взаимодействия между собой ( включая энергию межмолекулярного взаимодействия в среде, энергию поступательного и вращательного движения молекул, энергию внутримолекулярных колебаний атомов и атомных групп, энергию движения электронов и других частиц).
Внутренняя энергия системы это функция состояния вещества, её изменение не зависит от пути перехода из одного состояния в другое, а определяется лишь начальным и конечным состоянием системы.
Абсолютное значение внутренней энергии определить невозможно, можно определить только её изменение (DU).
В термодинамике обычно исследуют две формы передачи энергии от одной системы к другой – теплоту и работу.
Теплота (Q) – микроскопическая форма передачи энергии при столкновении хаотически движущихся молекул и атомов соприкасающихся тел.
Под работой (А) подразумевается работа системы против внешних сил (давления, электрических и магнитных полей и др.)
В отличие от внутренней энергии, работа и теплота не являются функциями состояния системы, они зависят от вида процесса и их изменение зависит от пути процесса. С учётом этого математическая формулировка первого закона термодинамики будет иметь вид:
δQ = dU + δA, (1.4)
где dU – полный дифференциал внутренней энергии системы;
δQ – бесконечно малое изменение теплоты;
δА – бесконечно малое изменение работы.
В последнем уравнении знак полного дифференциала (d) характеризует функцию состояния системы U, а знак δ характеризует бесконечно малое изменение свойств системы Q и А, которые не являются функциями состояния.
Если система переходит из одного состояния характеризуемого объёма V1 в другое, с объёмом V2 то:
 , где А¢ - работа против всех сил, действующих на систему, кроме внешнего давления. рDV – работа расширения системы.
, где А¢ - работа против всех сил, действующих на систему, кроме внешнего давления. рDV – работа расширения системы.
Если изучаемая система находится только под действием давления, то A = рDV, тогда 1-ый закон термодинамики имеет вид:  .
.
1) Для изохорных процессов (V=const, ΔV=0):
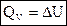 , т. е. теплота расходуется только на изменение внутренней энергии.
, т. е. теплота расходуется только на изменение внутренней энергии.
2) При постоянном давлении (изобарные процессы):

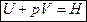 , где Н – энтальпия (теплосодержание системы), т. е.
, где Н – энтальпия (теплосодержание системы), т. е.
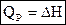
Энтальпия – функция состояния системы, она не зависит от пути перехода системы из одного состояния в другое. Абсолютное значение энтальпии определить невозможно, можно определить только её изменение. В термохимии изменение энтальпии называют тепловым эффектом реакции.
Энтальпия процесса 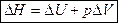
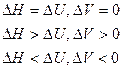
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 817; Нарушение авторских прав?; Мы поможем в написании вашей работы!