
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Модели атома
|
|
|
|
Еще в V веке до нашей эры Демокритом была высказана идея о существовании мельчайших неделимых частиц, которые он назвал атомами. Более двух тысяч лет понадобилось человечеству, чтобы установить существование структуры атома, составными частями которого являются более мелкие частицы. В 1897 году первая такая частица – электрон была открыта английским ученым Джозефом Джоном Томсоном. Как он вспоминал много позже, к такому заключению он пришел с большой неохотой, основываясь на результатах своих экспериментов.
О сложной структуре атома свидетельствовали и эксперименты, выполненные французским ученым Анри Беккерелем[6], который, работая с солями урана, обнаружил невидимое излучение, названное им «урановыми лучами». В 1900 году Резерфорду[7] удалось доказать, что в составе этих лучей есть отрицательно заряженные частицы (названные им β-частицами), которые, как оказалось позднее, являются электронами. Другой вид частиц, входивших в состав урановых лучей, был им назван α-частицами. Как показали исследования, эти частицы имели положительный заряд и массу, в ~ 7500 раз больше массы электрона. В результате этих открытий стало ясно, что атом имеет сложную структуру – из него вылетают и легкие, и тяжелые частицы.
Среди создаваемых в это время моделей атома наибольшую популярность приобрела модель Томсона, получившая название «пудинг с изюмом», представленную на рис.12.5. Согласно этой модели атом представляет собой положительно заряженный шар, внутри которого (как изюм в булке) располагались электроны. При попытке согласовать модель с данными спектроскопии и периодической таблицей Д.И.Менделеева, Томсон был вынужден включить в состав модели около тысячи электронов. Они располагались по концентрическим кольцам и имели каждый свою частоту колебаний.
Таким образом, модель Томсона оказалась очень сложна и имела большое количество параметров. К тому же она не объясняла целый ряд экспериментальных результатов. При этом она сыграла важную роль в формировании современных представлений об атоме. Дальнейшее развитие представлений о внутренней структуре атома было сделано Резерфордом и его учениками.
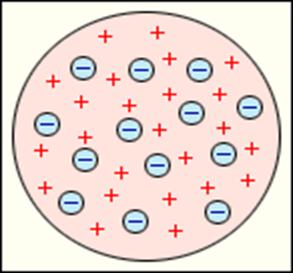
Рис.12.5. Модель Томсона.
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 316; Нарушение авторских прав?; Мы поможем в написании вашей работы!