
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Корпускулярно-волновой дуализм
|
|
|
|
Квантовая механика
Квантовая механика. Корпускулярно-волновой дуализм. Волновая функция. Уравнение Шредингера. Соотношение неопределенностей. Квантовая картина строения атома. Принцип Паули. Примеры приборов, действующих на принципах квантовой механики.
Квантовая механика возникла на основе удивительных открытий конца XIX – начала ХХ веков. В конце XIX был открыт электрон и стало понятно, что атом тоже из чего-то состоит. Кроме того, были открыты катодные лучи, затем рентгеновские Х-лучи. Также оказалось, что из некоторых ядер вылетают α-, β-, и γ-лучи. Причем физики установили, что первые два вида лучей – это электроны и ядра гелия соответственно, а третий вид – нейтральное сильно проникающее излучение, которые оказались фотонами высоких энергий или γ-квантами. Открытие фотоэффекта, гипотеза квантов Планка, модели атома Резерфорда и Бора - все это было базой для создания квантовой теории и более совершенной модели атома. Физики понимали, что электроны внутри ядра двигаются с огромной скоростью и говорить о каком – либо точном положении электрона в атоме было бы неверно. Поэтому представление об электроне, скачущем с одной орбиты на другую, было слабым приближением к реальности. Нужны были другие подходы к описанию атома.
Накопление огромного экспериментального материала и целого ряда теоретических представлений позволило сделать шаг к созданию новой модели атома. Развитие квантовой теории связано с именами величайших физиков двадцатого века – Кюри, Рентгеном, Беккерелем, Резерфордом, Бором, Планком, Эйнштейном и другими.
Последней ступенькой к этому стала гипотеза Луи де Бройля и соотношение неопределенности Гейзенберга.
Луи де Бройль[1] в 1923 году дал обоснование теории Бора, основываясь на законах симметрии природы. Он предположил, что если фотоны обладают волновыми и корпускулярными свойствами, то и любые другие частицы, например электроны, наряду с корпускулярными свойствами обладают также волновыми свойствами. В этом случае частице массы m, движущейся со скоростью v, соответствует длина волны λ, называемая дебройлевской длиной волны:
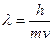 (13.1.1)
(13.1.1)
Каждому электрону в атоме, считал де Бройль, соответствует стоячая волна. Хорошо известно, что в пространстве, ограниченном стенками, могут возникнуть лишь стоячие волны, а остальные будут затухать. Такие волны по гипотезе де Бройля могут возникать вдоль орбиты атома, как показано на рис.13.1. В этом случае, возникшие стоячие волны будут замыкаться на себя, то есть на длине орбиты должно помещаться целое число волн:

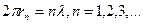 (13.1.2)
(13.1.2)
Подставляя (13.1.1) в (13.1.2), получаем:
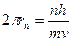
 (13.1.3)
(13.1.3)
или
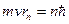 (13.1.4)
(13.1.4)
Выражение (13.1.4) представляет собой один из постулатов Бора или, как принято его называть, условие квантования. Используя это условие, получаются дискретные значения радиусов орбит и энергий атомов. Отсюда следует, что корпускулярно – волновой дуализм заложен в самой структуре атома. Однако круговые стоячие волны – это не траектории движения электрона, а, поскольку электроны внутри атома движутся с большими скоростями (порядка 1000 км/с), они представляют собой моды колебаний электронного облака «размытого вокруг атома». Таким образом, любой частице может быть приписана определенная длина волны.
Рис.13.1. Стоячие волны вдоль орбиты электрона.
Спустя несколько лет его гипотеза была подтверждена экспериментально. К.Д. Дэвиссон и Л.Х. Джермер в 1927 году, исследуя рассеяние электронов на поверхности металла, обнаружили дифракционную картину (рис.13.2). Позднее этот же эффект наблюдали для других частиц.
С другой стороны ранее был открыт фотоэффект – рассеяние фотона на связанном (с атомом) электроне, а также Комптон – эффект – аналогичное рассеяние фотона на свободном (не связанном с атомом) электроне. Объяснить оба эффекта можно в случае, если фотон представляет собой не волну, а частицу. Это отличается от представлений классической физики, где свет имеет волновую природу.

Рис. 13.2. Дифракция электронов.
Таким образом, был сформулирован принцип дополнительности, который утверждает, что полное понимание природы света и материи требует учета как волновых, так и корпускулярных свойств.
Эти представления являются лишь моделью той реальности, которую мы изучаем. В одних случаях применима волновая модель, в других – корпускулярная. Квантовая механика базируется на обоих свойствах материи.
Анализ недостатков теории Бора при ее огромной значимости для развития физики атома позволил понять, почему в начале 20-х годов прошлого века многие физики стали все более отчетливо сознавать необходимость создания новой, более последовательной теории. И менее чем через два года после того, как де Бройль выдвинул гипотезу о волнах материи, Эрвин Шредингер[2] (1887 – 1961) и Вернер Гейзенберг[3] (1901 – 1976) независимо разработали новую, более общую теорию.
Новая теория, получившая название квантовой механики, воссоздала из корпускулярно-волнового дуализма единую последовательную теорию.
Квантовая механика – это теория, устанавливающая способ описания и законы движения микрочастиц, связь величин, описывающих частицы и системы.
Для квантовой механики справедлив принцип соответствия – она дает для макросистем те же выводы, что и классическая теория.
Квантовая механика и вероятностная модель атома представляли собой следующий этап (по сравнению с моделями Томсона, Резерфорда и Бора) понимания как устроены атомы. Как теория квантовая механика имела необычайный успех. Она блестяще, до мельчайших деталей решила проблему спектров сложных атомов; она объяснила относительную яркость спектральных линий и образование молекул из атомов; она представляет собой несравненно более общую теорию, которая охватила всю совокупность квантовых явлений от излучения черного тела до структуры атомов и молекул. Квантовая теория оказалась столь успешной, что сейчас все физики считают ее фундаментальной теорией, лежащей в основе физических процессов.
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 710; Нарушение авторских прав?; Мы поможем в написании вашей работы!