
- Р Р‡.МессенРТвЂВВВВВВВВжер
- ВКонтакте
- РћРТвЂВВВВВВВВнокласснРСвЂВВВВВВВВРєРСвЂВВВВВВВВ
- РњРѕР№ Р В Р’В Р РЋРЎв„ўР В Р’В Р РЋРІР‚ВВВВВВВВРЎР‚
- LiveJournal
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Фазовые переходы. Критическая точка
|
|
|
|
Жидкость, например вода, может находиться в твердом, жидком и газообразном состоянии, которые называют фазовыми состояниями вещества. В жидкостях расстояния между молекулами примерно на два порядка меньше, чем в газах. В твердом веществе молекулы расположены еще ближе друг к другу. Температура, при которой меняется фазовое состояние вещества (жидкое – твердое, жидкое – газообразное), называется температурой фазового перехода.
Теплотой фазового перехода или скрытой теплотой называется величина теплоты плавления или испарения вещества. На рис.6.9 представлена зависимость температуры воды от количества получаемого тепла в калориях. Видно, что при температурах 00С и 1000С происходит изменение фазового состояния воды, а температура воды при этом не изменяется. Поглощенное тепло расходуется на изменение фазового состояния вещества. Физически это означает, что при нагревании твердого тела, например, льда при 00С происходит увеличение амплитуды колебаний молекул друг относительно друга. Это приводит к возрастанию их потенциальной энергии, и, следовательно, к ослаблению или разрыву межмолекулярных связей. Молекулы или их скопления получают возможность перемещаться друг относительно друга. Лед превращается при неменяющейся температуре в жидкость. После изменения его агрегатного состояния из твердого в жидкое, поглощение теплоты приводит к возрастанию температуры по линейному закону. Так происходит до 1000С. Затем энергия колеблющихся молекул возрастает настолько, что молекулы способны преодолеть притяжение остальных молекул. Они бурно отрываются не только от поверхности воды, но и образуют пузыри из пара по всему объему жидкости. Они поднимаются к поверхности под действием выталкивающей силы и выбрасываются наружу. В этом фазовом переходе вода превращается в пар. Далее опять поглощение теплоты приводит к возрастанию температуры пара по линейному закону.
Теплота, выделяющаяся или поглощающаяся при фазовом переходе, зависит от массы вещества.
При переходе вещества массы m из жидкого в газообразное состояние или, наоборот, из газообразного в жидкое поглощается или выделяется теплота Q:

Удельной теплотой парообразованияr называется количество теплоты Q, необходимое для превращения в пар 1 кг жидкости при температуре кипения:
 . (6.8.1)
. (6.8.1)
При переходе вещества из твердого состояния в жидкое и обратно поглощается или передается количество теплоты:
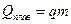
Удельной теплотой плавления q называется количество теплоты Q, необходимое для превращения 1 кг твердого вещества (например, льда) в жидкость при температуре плавления:
 . (6.8.2)
. (6.8.2)
Удельная теплота плавления и парообразования измеряется в Дж/кг. С ростом температуры удельная теплота парообразования уменьшается, а при критической температуре становится равной нулю.
Для воды удельная теплота плавления и парообразования соответственно составляют:
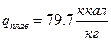 ,
, 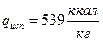 .
.
Здесь используется внесистемная единица измерения количества энергии – калория, равная количеству теплоты, необходимому для нагревания 1 грамма воды на 1 °C при нормальном атмосферном давлении 101.325 кПа.
Как видно на рис.6.17 для нагревания льда от -200С до 00С необходимо в восемь раз меньше энергии, чем для превращения ее из льда в воду, и в 54 раза меньше, чем превратить воду в пар.
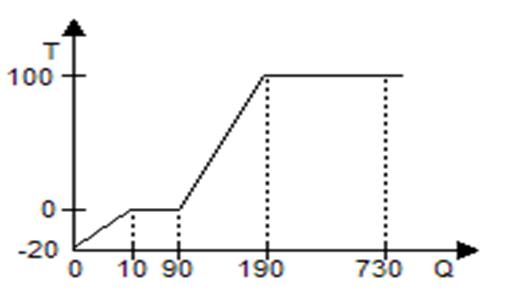
Рис.6.17. Зависимость температуры от подводимой к системе теплоты
для 1 кг льда.
Температура, при которой теряется различие между паром и жидкостью, называется критической. На рис. 6.18 иллюстрируется понятие критической температуры на зависимости плотности воды и пара от температуры. При нагревании воды в закрытой пробирке, как видно на рис.6.18, плотность воды с ростом температуры уменьшается из-за объемного расширения воды, а плотность пара возрастает. При некоторой температуре, которая и называется критической, плотность пара становится равной плотности воды.
У каждого вещества своя критическая температура. Для воды, азота и гелия критические температуры соответственно составляют:
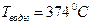 ,
, 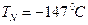 ,
,  .
.
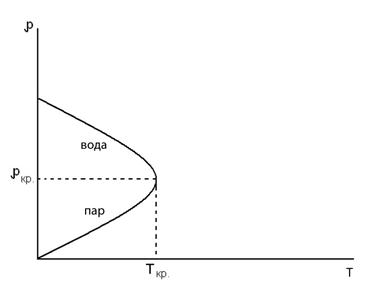
Рис.6.18. Критическая точка на графике зависимости
плотности пара и воды от температуры.
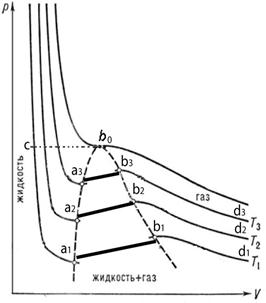
Рис.6.19. Зависимость давления от объема p=p(V) для пара. В области, выделенной пунктиром, газообразное и жидкое состояния вещества существуют одновременно.
На рис.6.19 представлена зависимость давления пара от его объема Р=Р(V). Уравнение состояния пара при низком давлении и вдали от температуры его фазового перехода (выше точки b0 на рис.6.19) близко к уравнению состояния идеального газа (то есть в этом случае газ можно считать идеальным и его поведение хорошо описывается законом Бойля - Мориотта). С уменьшением температуры зависимость Р=Р(V) начинает отличаться от ее вида для идеального газа. На участке а – b происходит конденсация пара и давление пара почти не меняется, а зависимость на рис.6.19 представляет собой медленно спадающую линейную функцию. Ниже точки а, весь пар становится жидкостью, и далее происходит уже сжатие жидкости.В этом случае, как видно на рис.6.11, давление при очень незначительном уменьшении объема, поскольку жидкость практически несжимаема, резко возрастает.
Поскольку температура фазового перехода зависит от давления газа, можно представить фазовые переходы, используя зависимость давления от температуры Р=Р(Т) на рис.6.20. Изменение фазового состояния вещества происходит на границе пар - жидкость, твердое тело - жидкость, твердое тело - пар. С разных сторон этих граничных линий газ находится в разном агрегатном состоянии – твердом, жидком или газообразном.
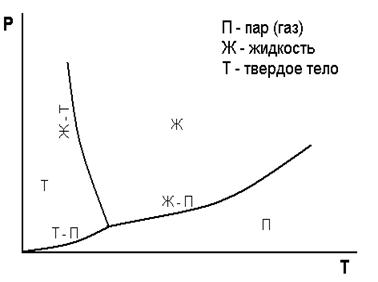
Рис.6.20. Фазовая диаграмма для воды.
Точка пересечения трех линий на рис.6.12 называется тройной точкой. Например, вода при температуре 00С и давлении  атм., имеет тройную точку, а углекислый газ имеет тройную точку при температуре
атм., имеет тройную точку, а углекислый газ имеет тройную точку при температуре  и давлении P=5,1 атм. На рис.6.20 видно, что возможен переход вещества из газообразного в твердое состояние и наоборот, минуя жидкую стадию.
и давлении P=5,1 атм. На рис.6.20 видно, что возможен переход вещества из газообразного в твердое состояние и наоборот, минуя жидкую стадию.
Переход из твердого состояния вещества в газообразное состояние называют сублимацией.
Пример: охлаждение сухим льдом, например, пачек мороженного, находящихся на лотках. В этом случае, как мы неоднократно видели, сухой лед превращается в пар.
|
|
|
Дата добавления: 2014-01-06; Просмотров: 1796; Нарушение авторских прав?; Мы поможем в написании вашей работы!