
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Введение в термодинамику необратимых процессов
|
|
|
|
Принцип Ле Шателье-Брауна.
Из закона возрастания энтропии следует, что энтропия адиабатически замкнутой системы возрастает до тех пор, пока в ней не затихнут все необратимые процессы.
Поэтому условие устойчивости состояния термодинамической системы можно сформулировать следующим образом: если энтропия адиабатически изолированной системы достигает максимального значения, то состояние системы термодинамически устойчиво.
Принцип Ле Шателье-Брауна гласит, что если на систему действуют внешние факторы, выводящие её из состояния устойчивого равновесия, то в системе возникают процессы, стремящиеся ослабить это воздействие. Принцип является термодинамическим аналогом закона индукции Ленца.
Значение принципа Ле Шателье-Брауна состоит в том, что он позволяет предсказывать направление, в котором под влиянием внешнего воздействия изменится термодинамический процесс.
Например, если смеси воды и льда, находящейся в равновесии при 0 0С, сообщать теплоту, то лёд начнет таять с поглощением этой теплоты. Если наоборот, отводить теплоту, то вода начнёт замерзать с выделением теплоты.
В термодинамической системе при протекании равновесных процессов давление и температура во всех точках системы должны быть одинаковыми. Иначе эти процессы будут протекать необратимым образом.
Для описания необратимых процессов используют гипотезу локального равновесия, которая предполагает, что внутри малого объёма выполняется основное уравнение термодинамики равновесных процессов.
Для этого рассматривают удельные величины: внутреннюю энергию малого объема u, энтропию s, удельный объём 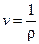 , (r - локальная плотность в точке, задаваемой радиус-вектором
, (r - локальная плотность в точке, задаваемой радиус-вектором 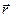 в момент времени t), для которых выполняется соотношение
в момент времени t), для которых выполняется соотношение 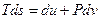 . В этом случае внутренняя энергия U некоторого выделенного объёма и энтропия S будут равны:
. В этом случае внутренняя энергия U некоторого выделенного объёма и энтропия S будут равны: 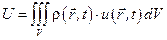 ,
, 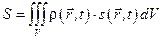 .
.
Для описания процессов вводится понятие производства энтропии для единичного объема адиабатически изолированной системы: 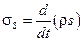 . Если состояние системы описывается несколькими параметрами, то
. Если состояние системы описывается несколькими параметрами, то 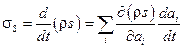 , где величины
, где величины 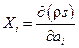 называются термодинамическими силами, а величины
называются термодинамическими силами, а величины 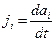 - плотностями термодинамических потоков.
- плотностями термодинамических потоков.
С учётом этих обозначений производство энтропии равно:
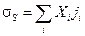 .
.
В равновесном состоянии энтропия принимает максимальное значение, поэтому
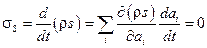 .
.
При небольших отклонениях от равновесного состояния между термодинамическими потоками и термодинамическими силами может быть установлена линейная зависимость:
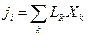 ,
,
что соответствует наиболее простому случаю термодинамики линейных необратимых процессов. Таким образом производство энтропии является квадратичной функцией от термодинамических потоков:
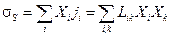 .
.
Коэффициенты Lik называются кинетическими коэффициентами. Соотношение взаимности Л.Онсагера гласит, что эти коэффициенты симметричны относительно перестановки индексов
Lik= Lki.
Для описания неравновесных процессов применяют принцип минимума производства энтропии Пригожина: стационарное состояние системы, в которой происходит необратимый процесс, характеризуется тем, что скорость возникновения энтропии имеет минимальное значение при данных внешних условиях, препятствующих достижению системой равновесного состояния.
Принцип минимума производства энтропии позволяет установить критерий отбора реализующихся в природе необратимых процессов от процессов реально не наблюдавшихся. Таким образом, из всех возможных процессов реально осуществляются только те, которые сопровождаются минимумом производства энтропии.
Исследование необратимых стационарных процессов показывает, что в системе могут существовать динамические структуры, также называемые диссипативными, образование которых приводит к уменьшению производства энтропии. Примерами являются ячейки Бенара или колебательные химические реакции Белоусова.
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 535; Нарушение авторских прав?; Мы поможем в написании вашей работы!