
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические связи в кристаллах
|
|
|
|
 Кристаллы классифицируются по типу химической связи между частицами. В установлении химических связей участвуют, в основном, электрические силы взаимодействия валентных электронов. По физической природе сил, действующих между частицами решетки, различают связи ионные, металлические, межмолекулярные и ковалентные.
Кристаллы классифицируются по типу химической связи между частицами. В установлении химических связей участвуют, в основном, электрические силы взаимодействия валентных электронов. По физической природе сил, действующих между частицами решетки, различают связи ионные, металлические, межмолекулярные и ковалентные.
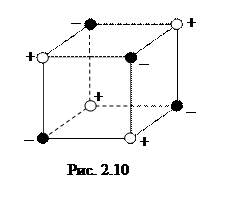
Ионная связь. В узлах кристаллических решеток ионных кристаллов находятся разноименные ионы (рис. 2.10). Каждый ион в решетке окружен со всех сторон ионами противоположного знака. Поэтому силы притяжения между ионами превышают силы отталкивания, возникающие между ионами одного знака. Ионным кристаллам присуща высокая энергия связи, которая служит причиной высокой прочности и высокой температуры плавления ионных кристаллов.
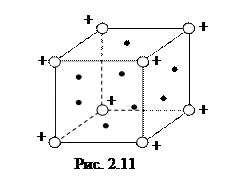 Металлическая связь. Эта связь характерна для металлов. В узлах решетки металлов находятся положительные ионы, химическая связь между которыми осуществляется с помощью свободных электронов, образующих электронный газ (рис. 2.11). Металлическая связь возникает в том случае, когда в атомах невелико число валентных электронов, при этом они слабо связаны с ядрами. При образовании металлов электронные оболочки валентных электронов перекрываются. Поэтому валентные электроны получают возможность переходить от одного атома к другому и свободно перемещаться по всему кристаллу. Свободные электроны как бы связывают положительные ионы в прочную структуру.
Металлическая связь. Эта связь характерна для металлов. В узлах решетки металлов находятся положительные ионы, химическая связь между которыми осуществляется с помощью свободных электронов, образующих электронный газ (рис. 2.11). Металлическая связь возникает в том случае, когда в атомах невелико число валентных электронов, при этом они слабо связаны с ядрами. При образовании металлов электронные оболочки валентных электронов перекрываются. Поэтому валентные электроны получают возможность переходить от одного атома к другому и свободно перемещаться по всему кристаллу. Свободные электроны как бы связывают положительные ионы в прочную структуру.
Межмолекулярная связь. Наблюдается в молекулярных кристаллах, содержащих в своих узлах устойчивые молекулы. Между молекулами действуют слабые силы междумолекулярного притяжения. Природа этих сил сводится к взаимодействию молекулярных диполей. Молекулы, образующие такие кристаллы, обычно полярны, то есть обладают дипольным моментом. Диполи молекул ориентируются так, что обращенные друг к другу концы соседних диполей разнополярны, и силы притяжения преобладают над силами отталкивания.
Ковалентная связь в кристаллах, как и в молекулах, осуществляется посредством электронных пар. Этой связью обладает большинство полупроводниковых соединений. В узлах решетки располагаются нейтральные атомы. Ковалентная связь имеет направленный характер, она образуется в том направлении, где плотность электронного облака спаренных электронов наибольшая. Другими словами, каждый атом решетки может взаимодействовать только с определенными атомами, а не со всеми как в ионных кристаллах. Наиболее характерные ковалентные кристаллы образуются элементами четвертой группы периодической таблицы: углерод, германий, кремний.
В кристаллах германия и кремния атомы располагаются упорядоченно на таких расстояниях друг от друга, что их внешние электронные оболочки перекрываются и уровни s и р расщепляются в единую энергетическую зону.
В нормальном состоянии распределение валентных электронов в атомах этих элементов следующее: для углерода 2 s 22 p 2, для кремния 3 s 23 p 2 и для германия 4 s 24 p 2. В процессе образования кристалла происходит разделение спаренных s электронов, и один из них переходит на р уровень. В результате все четыре электрона становятся практически идентичными, с одинаковым видом электронного облака. Каждый атом с помощью этих четырех электронов взаимодействует с другими (рис.2.12,а). Взаимодействие внешних электронных оболочек проявляется в том, что у электронов соседних атомов появляются общие орбиты, на которых в соответствии с принципом Паули не может находиться больше двух электронов с противоположными спинами. Эти общие орбиты связывают между собой атомы у германия и кремния посредством ковалентной связи.
 |
На рис. 2.12,б показано схематическое изображение кристаллографической плоскости полупроводникового материала.
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 2302; Нарушение авторских прав?; Мы поможем в написании вашей работы!