
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Курс лекций
|
|
|
|
МАТЕРИАЛОВЕДЕНИЕ
СОДЕРЖАНИЕ
| ВВЕДЕНИЕ | |
| 1. ЦЕЛИ И ЗАДАЧИ МАТЕРИАЛОВЕДЕНИЯ. ОСНОВНЫЕ ПОНЯТИЯ О МЕТАЛЛАХ И ИХ СВОЙСТВАХ | |
| 2. АТОМНО-КРИСТАЛЛИЧЕСКОЕ СТРОЕНИЕ МЕТАЛЛОВ | |
| 2.1. Строение реальных кристаллов | |
| 2.2. Дефекты кристаллического строения | |
| 2.3. Превращения в твердом состоянии. Полиморфизм | |
| 3. КРИСТАЛЛИЗАЦИЯ МЕТАЛЛОВ И СПЛАВОВ | |
| 3.1. Энергетические условия процесса кристаллизации | |
| 3.2. Механизм процесса кристаллизации | |
| 3.3. Аморфное состояние металлов | |
| 3.4. Реальная форма кристаллических образований | |
| 3.5. Получение монокристаллов | |
| 3.6. Жидкие кристаллы | |
| 3.7. Строение стального слитка | |
| 3.8. Методы исследования структуры | |
| 4. МЕХАНИЧЕСКИЕ СВОЙСТЬВА МЕТАЛЛОВ И СПЛАВОВ | |
| 4.1. Упругая и пластическая деформация. Несовершенства решетки и прочность металлов | |
| 4.2. Методы испытаний металлов и сплавов | |
| 4.3. Конструкционная прочность металлов и сплавов | |
| 4.4. Пути повышения прочности металлов | |
| 4.5. Влияние нагрева на строение и свойства деформированного металла (рекристаллизация) | |
| 5. ОСНОВЫ ТЕОРИИ СПЛАВОВ | |
| 5.1. Строение сплавов | |
| 5.2. Химические соединения | |
| 5.3. Электронные соединения (фазы ЮМ-РОЗАРИ) | |
| 5.4. Механические смеси | |
| 6. ДИАГРАММА СОСТОЯНИЯ | |
| 6.1. Построение диаграмм состояния (равновесия) | |
| 6.2. Правило отрезков или правило рычага | |
| 6.3. Диаграмма состояния для сплавов, образующих механические смеси из чистых компонентов (I рода) | |
| 6.4. Диаграмма состояния для сплавов с ограниченной растворимостью в твердом состоянии (III рода) | |
| 6.5. Диаграмма с перитектикой | |
| 6.6. Диаграмма для сплавов, образующих химические соединения (IV рода) | |
| 6.7. Диаграмма состояния для сплавов, испытывающих полиморфные превращения | |
| 6.8. Связь диаграммы состояния сплава с его свойствами | |
| 7. АНАЛИЗ ДИАГРАММЫ «ЖЕЛЕЗО – УГЛЕРОД» | |
| 7.1. Характеристика линий и точек диаграммы «железо-углерод» | |
| 7.2. Практическое применение диаграммы «железо-углерод» | |
| 7.3. Классификация сплавов системы «железо-углерод» | |
| 8. ОСНОВЫ ТЕОРИИ ТЕРМИЧЕСКОЙ ОБРАБОТКИ | |
| 8.1. Четыре основные превращения в стали | |
| 8.2. Превращения в стали при нагреве – образование аустенита (I превращение) | |
| 8.3. Превращение в стали при охлаждении (II превращение) | |
| 8.4. Перлитное превращение | |
| 8.5. Бейнитное превращение | |
| 8.6. Превращение аустенита при непрерывном охлаждении | |
| 8.7. Мартенситное превращение (III превращение) | |
| 8.8. Превращение в закаленной стали при нагреве (IV превращение) | |
| 9. ТЕХНОЛОГИЯ ТЕРМИЧЕСКОЙ ОБРАБОТКИ | |
| 9.1. Основные составляющие технологического процесса термической обработки | |
| 9.2. Классификация видов термической обработки | |
| 9.3. Способы закалки | |
| 9.4. Закаливаемость и прокаливаемость | |
| 10. ВНУТРЕННИЕ НАПРЯЖЕНИЯ | |
| 11. ОТПУСК | |
| 12. ХИМИКО - ТЕРМИЧЕСКАЯ ОБРАБОТКА (ХТО) | |
| 12.1. Цементация стали | |
| 12.2. Азотирование стали | |
| 13. ТЕРМОМЕХАНИЧЕСКАЯ ОБРАБОТКА | |
| 14. ЛЕГИРОВАННЫЕ СТАЛИ И СПЛАВЫ | |
| 14.1. Влияние легирующих элементов на превращения в сталях | |
| 14.2. Влияние легирующих элементов на кинетику распада аустенита | |
| 14.3. Влияние легирующих элементов на мартенситное превращение | |
| 14.4. Классификация легированных сталей | |
| 14.5. Принцип комплексного легирования | |
| 14.6. Технологические особенности термической обработки легированной стали | |
| 14.7. Особенности отпуска легированной стали | |
| 15. КОНСТРУКЦИОННЫЕ МАТЕРИАЛЫ | |
| 15.1. Классификация конструкционных сталей | |
| 16. ИНСТРУМЕНТАЛЬНЫЕ СТАЛИ И СПЛАВЫ | |
| 16.1. Режущие стали | |
| 16.2. Быстрорежущие стали | |
| 16.3. Твердые режущие стали | |
| 16.4. Штамповые стали | |
| 16.5. Стали для измерительных инструментов | |
| 17. СТАЛИ И СПЛАВЫ С ОСОБЫМИ СВОЙСТВАМИ | |
| 17.1. Нержавеющие (коррозионностойкие) стали | |
| 17.2. Жаростойкие и жаропрочные стали | |
| 17.3. Криогенные стали и сплавы | |
| 17.4. Магнитные стали и сплавы | |
| 17.5. Сплавы с особенностями электросопротивления | |
| 17.6. Сплавы с высоким электросопротивлением | |
| 17.7. Сплавы с заданным коэффициентом теплового расширения | |
| 18. ЦВЕТНЫЕ МЕТАЛЛЫ И СПЛАВЫ | |
| 18.1. Медные сплавы | |
| 18.2. Алюминиевые сплавы | |
| 18.3. Магниевые сплавы | |
| 18.4. Титан и его сплавы | |
| 18.5. Антифрикционные сплавы |
ВВЕДЕНИЕ
Увеличение в ХХI веке доли пластмасс, керамики и композитов сопровождается созданием качественно новых видов материалов, значительно превосходящих по свойствам многие металлические. Уменьшение доли металлических материалов сопровождается также качественным их изменением: практически все новые материалы имеют высоко-, сверх- или ультравысокие свойства.
В начале третьего тысячелетия наиболее распространенными среди металлических материалов останутся железные сплавы и прежде всего –стали.
Конец ХХ столетия характеризовался переходом к применению материалов в метастабильном состоянии, увеличился удельный вес обработки поверхности стали, использования в качестве теплового источника концентрированного потока энергии: наибольшее развитие получили вакуумные, ионные, лазерные и другие процессы.
В новом столетии будут продолжать развиваться на хорошем уровне плазменная, высокочастотная, индукционная, электронная термическая обработка.
В области инженерии поверхности интенсивное развитие в начале ХХI века получат комбинированные процессы, которые резко повышают эксплуатационные свойства поверхности. К ним прежде всего нужно отнести сочетание классических диффузионных процессов насыщения поверхности с нанесением на них покрытий толщиной 3-5 мкм методом химического и физического осаждения и паровой фазы.
Задачей курса «Материаловедение» (раздел металлов и сплавов) является возможность дать студентам - машиностроителям сведения о металлах и сплавах, путях улучшения их механических и эксплуатационных свойств.
1. ЦЕЛИ И ЗАДАЧИ МАТЕРИАЛОВЕДЕНИЯ. ОСНОВНЫЕ ПОНЯТИЯ О МАТЕРИАЛАХ И ИХ СВОЙСТВАХ
Материаловедение – наука, изучающая металлические и неметаллические материалы, применяемые в технике, объективные закономерности зависимости их свойств от химического состава, структуры, способов обработки и условий эксплуатации и разрабатывающая пути управления свойствами (рис. 1.1).

Рис. 1.1. Положение металловедения в общей структуре наук
Цель – познание свойств материалов в зависимости от состава и обработки, методов их упрочнения для наиболее эффективного использования в технике, а также создание материалов с заранее заданными свойствами: высокая прочность и пластичность, высокая электропроводность или высокое сопротивление, специальные магнитные свойства, сочетание различных свойств в одном материале (композиционные материалы).
Основные задачи материаловедения:
- раскрыть физическую сущность явлений, происходящих в материалах при воздействии на них различных факторов в условиях производства и эксплуатации;
- установить зависимость между составом, строением и свойствами материалов;
- изучить теорию и практику различных способов упрочнения материалов для повышения высокой надёжности и долговечности деталей, инструмента и изделий;
- изучить основные группы современных материалов, их свойства и области применения;
- дать понятия о современных методах исследования структуры и прогнозирования эксплуатационных свойств материалов и изделий.
Знакомство с основами материаловедения необходимо не только инженерам и научным работникам, но и любому современному человеку.
Как показывает практика и обширные научные исследования в области физики твердого тела (ФТТ) и материаловедения, наличие тех или иных свойств определяется внутренним строением сплавов. В свою очередь, строение сплава зависит от состава и характера предварительной обработки. Таким образом, можно установить следующие связи между характеристиками материала (рис. 1.2):
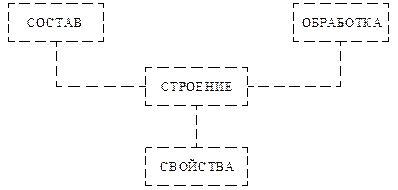
Рис. 1.2. Схема связей между характеристиками материала
Изучение представленных связей составляет предмет материаловедения. В результате изучения предмета студент должен уметь:
- правильно выбрать материал для изделия;
- назначать его обработку с целью получения заданной структуры и свойств;
- оценивать поведение материала при воздействии на него различных эксплуатационных факторов;
- определять опытным путем основные характеристики материалов.
Основную часть всех материалов составляют металлы.
В физике деление на металлы и неметаллы определяется по поведению электросопротивления материала: у металлов оно определяется электронным строением оболочек и при Т ® 0 К r ® 0, в то же время у неметаллов, т.е. полупроводников и диэлектриков при Т ® 0 r ® ¥.
Все металлы делятся на две большие группы: черные металлы и цветные металлы. В свою очередь, эти две группы делятся на подгруппы (рис. 1.3).

Рис. 1.3. Классификация металлов: а- черных; б- цветных
В зависимости от температуры и давления (для металлов в основном от температуры, Р-соnst) все вещества могут находиться в четырёх агрегатных состояниях: плазмообразном, газообразном, жидком и твердом.
Плазма – ионизированный газ, в котором объёмные плотности положительных и отрицательных электрических зарядов равны.
В газообразном состоянии атомы практически не связаны друг с другом и хаотически перемещаются в пространстве.
В жидком состоянии атомы слабо связаны друг с другом, существует ближний порядок, вещество занимает форму сосуда, части легко отделимы друг от друга.
В твердом состоянии атомы взаимодействуют друг с другом по определенному закону, в структуре имеется как ближний, так и дальний порядок, атомы образуют кристаллическую решетку того или иного вида.
Переход между агрегатными состояниями сопровождается изменением свободной энергии:
F = U – TS,
где U – внутренняя энергия;
T – температура;
S = q / T – энтропия (связана с теплом).
Исторически сложились два подхода к трактовке свойств и явлений, происходящих в твердых веществах, в частности в металлах:
- макроскопический или феноменологический;
- микроскопический или атомистический.
В макроскопическом подходе характерна трактовка твердого тела как сплошной среды без детализации его внутреннего строения. Подход взят на вооружение сопротивлением материалов и другими науками.
В микроскопическом подходе описание и объяснение свойств твердых тел основано на законах взаимодействия составляющих его частиц, т.е. на атомном уровне. В этом подходе реализуется цепочка: структура – свойство. Микроскопический подход на сегодня является единственным строго научным подходом к интерпретации наблюдаемых свойств и явлений в твердых телах.
2. АТОМНО-КРИСТАЛЛИЧЕСКОЕ СТРОЕНИЕ МЕТАЛЛОВ
Металлические материалы. 83 из известных 112 химических элементов таблицы Менделеева Д. И. являются металлами. Они обладают рядом характерных свойств:
- высокой тепло- и электропроводностью;
- положительным коэффициентом электросопротивления (с повышением температуры электросопротивление растет);
- термоэлектронной эмиссией (испусканием электронов при нагреве);
- хорошей отражательной способностью (блеском);
- способностью к пластической деформации;
- полиморфизмом.
Наличие перечисленных свойств обусловлено металлическим состоянием вещества, главным из которых является наличие легкоподвижных коллективизированных электронов проводимости.
Металлическое состояние возникает в совокупности атомов, когда при их сближении внешние (валентные) электроны теряют связь с отдельными атомами, становятся общими и свободно перемещаются между положительно заряженными, периодически расположенными ионами. Силы притяжения (силы связи) в твердых телах существенно отличаются по своей природе. Обычно рассматривают четыре основных типа связей в твердых телах: ван-дер-ваальсовые, ковалентные, металлические, ионную.
Под атомно-кристаллической структурой понимают взаимное расположение атомов в кристалле. Кристалл состоит из атомов (ионов), расположенных в определенном порядке, который периодически повторяется в трех измерениях. Наименьший комплекс атомов, который при многократном повторении в пространстве позволяет воспроизвести пространственную кристаллическую решётку, называют элементарной ячейкой.
Для характеристики элементарной ячейки используют параметры кристаллической решётки: три ребра а, в, с, измеряемых в ангстремах (1Å = 1* 10-8см) или в килоиксах – kX (1kX = 1,00202 Å) и три угла a, b, g, а также компактность структуры h - отношение объема, занимаемого атомами, к объёму ячейки (для решётки ОЦК h = 64 %, для решётки ГЦК h = 74 %) и координационное число К - число ближайших соседей данного атома: для решётки ОЦК это число равно 8, т.е. атомы, находящиеся в вершине, принадлежат восьми элементарным ячейкам (рис.2.1.а), для решётки ГЦК это число равно 12, т.е. атомы, находящиеся в вершине, принадлежат двенадцати элементарным ячейкам (рис. 2.1.б).

Рис.2.1. Схема определения координационного числа кристаллической решётки: а – ГЦК; б – ОЦК; в – ГПУ
Простейшим типом кристаллической ячейки является кубическая решётка. В простой кубической решётке атомы расположены (упакованы) недостаточно плотно.
Стремление атомов металла занять места, наиболее близкие друг к другу, приводит к образованию решеток других типов (рис. 2.2):
- объёмноцентрированной кубической решётки (ОЦК) (рис.2.2а) с параметром
а = 0,28 – 0,6мм = 2,8 – 6,0 Å
- гранецентрированной кубической решётки (ГЦК) (рис.2.2б) с параметром
а = 0,25мм
- гексагональной плотно упакованной решётки (ГПУ) (рис.2.2в) с параметром
с / а» 1,633

Рис. 2.2. Кристаллические решётки: а – гранецентрированный куб (ОЦК); б – объемноцентрированный куб (ГЦК); в- гексагональная плотно упакованная (ГПУ)
Узлы (положения атомов), направления в плоскости и в пространстве обозначаются с помощью так называемых индексов Миллера (рис. 2.3). Индексы узла записываются – (mnp), индексы направления - [mnp], индекс плоскости - (hk1).

Рис. 2.3. Символы некоторых важнейших узлов, направлений и плоскостей в кубической решётке
Вследствие неодинаковой плотности атомов в различных плоскостях и направлениях решётки многие свойства отдельно взятого кристалла (химические, физические, механические) по данному направлению отличаются от свойств в другом направлении и, естественно, зависят от того, сколько атомов встречается в этом направлении. Различие свойств в зависимости от направления испытания носит название анизотропии. Все кристаллы анизотропны. Анизотропия – особенность любого кристалла, характерная для кристаллического строения.
Технические металлы являются поликристаллами, т.е. состоят из совокупности кристаллитов с различной ориентацией. При этом свойства во всех направлениях усредняются.
2.1. Строение реальных кристаллов
Реальный кристалл состоит из скопления большого числа мелких кристаллов неправильной формы, которые называются зернами или кристаллитами (рис. 2.4).

Рис. 2.4. Блочная структура кристалла: схема (а); реальная блочная структура в алюминии (б), наблюдаемая в электронном микроскопе на просвет, (х 35000)
Зерно не является монолитным кристаллом, построенным из строго параллельных атомных слоев. В действительности оно состоит как бы из мозаики отдельных блоков, кристаллографические плоскости в которых повернуты друг относительно друга на небольшой угол – порядка нескольких минут. Такое строение зерна носит название мозаичной структуры, а составляющие ее блоки называются блоками мозаики.
Часто блоки объединяются в более крупные агрегаты – так называемые фрагменты. Фрагменты в свою очередь разориентированы относительно друг друга в несколько градусов. Зерна ориентированы случайно по отношению друг к другу. Преимущественная ориентация зерен называется текстурой. Поверхность раздела зерен называется границей.
Технические металлы являются поликристаллами, т.е. состоят из совокупности кристаллитов с различной ориентацией, что приводит к изменению свойств металлов при различных процессах их обработки.
При определенных условиях, обычно при очень медленном контролируемом отводе тепла при кристаллизации, может быть получен кусок металла, представляющий собой один кристалл, который называют монокристаллом.
2.2. Дефекты кристаллического строения
Строение реальных кристаллов отличается от идеальных. Реальные кристаллы всегда содержат несовершенства (дефекты) кристаллического строения, которые нарушают связи между атомами и оказывают влияние на свойства металлов.
Дефекты в кристаллах принято классифицировать по характеру их измерения в пространстве:
1. Точечные. Точечными дефектами называются нарушения периодичности кристалла, размеры которых сопоставимы с размерами атома во всех измерениях.
К точечным дефектам относятся вакансии, межузельные атомы, примеси замещения, примеси чужеродных атомов внедрения (рис. 2.5).

Рис. 2.5.Точечные дефекты в кристаллической решетке: а- вакансия;
б - межузельный атом; в- дефект Френкеля; г- примесные атомы замещения (большой) и внедрения (маленький).
Стрелками указаны направления смещений атомов в решетке.
Вакансии и межузельные атомы появляются в кристаллах при любой температуре выше абсолютного нуля из-за тепловых колебаний атомов. Каждой температуре соответствует равновесная концентрация вакансий, а также межузельных атомов. Например, в меди при температуре 20-25 оС содержится 10-13 ат. % вакансий, а вблизи точки плавления - уже 0,01 ат. % (одна вакансия приходится на 104 атомов).
Пересыщение точечными дефектами достигается при резком охлаждении после высокотемпературного нагрева, при пластическом деформировании и при облучении нейтронами. Чем выше температура, тем больше концентрация вакансий и тем чаще они переходят от узла к узлу. Вакансии являются самой важной разновидностью точечных дефектов; они ускоряют все процессы, связанные с перемещениями атомов: диффузию, спекание порошков и т. д.
2. Линейные. Линейные дефекты в кристаллах характеризуются тем, что их поперечные размеры не превышают нескольких межатомных расстояний, а длина может достигать размера кристалла. К линейным дефектам относятся дислокации – линии, вдоль и вблизи которых нарушено правильное периодическое расположение атомных плоскостей кристалла.
Важнейшие виды линейных несовершенств - краевые и винтовые дислокации (рис.2.6).

а б
Рис. 2.6. Схема дислокаций: а – краевая; б - винтовая
Краевая дислокация в сечении представляет собой край «лишней» полуплоскости в решетке (рис.2.7)

Рис. 2.7. Сечение простой кубической решетки: а - с краевой дислокацией; б - без дислокации.
Вокруг дислокаций решетка упруго искажена. Схема образования атмосферы Коттрелла в кристалле представлена на рисунке 2.8.

Рис. 2.8. Образование атмосферы Коттрелла: а – атомы примеси замещения (заштрихованы) и внедрения беспорядочно расположены в решетке; б, в – атомы примеси переместились к дислокации, в результате чего энергия решетки понизилась.
3. Поверхностные (двумерные ). Под этими дефектами понимают нарушения, которые обладают большой протяженностью в двух измерениях и протяженностью лишь в несколько межатомных расстояний в третьем измерении.
К поверхностным дефектам относятся дефекты упаковки, двойниковые границы, границы зерен.
4. Объемные (трехмерные ). Под ними понимают нарушения, которые в трех измерениях имеют неограниченные размеры. К таким нарушениям относят трещины, поры, усадочные раковины.
2.3. Превращения в твердом состоянии. Полиморфизм
Атомы данного элемента могут образовать, если исходить только из геометрических соображений, любую кристаллическую решетку. Однако устойчивым, а следовательно, реально существующим типом является решетка, обладающая наиболее низким запасом свободной энергии.
Так, разные металлы образуют разные виды кристаллической решетки:
- Li, Na, K, Mo, W – ОЦК;
- Al, Ca, Cu, Au, Pt – ГЦК;
- Mg, Zr, Hf, осмий – ГПУ.
Однако в ряде случаев при изменении температуры или давления может оказаться, что для одного и того же металла более устойчивой будет другая решетка, чем та, которая существует при данной температуре или давлении. Так, например, существует железо с решетками объемно-центрированного и гранецентрированного кубов, обнаружен кобальт с гранецентрированной и с гексагональной решетками.
Существование одного и того же металла (вещества) в нескольких кристаллических формах носит название полиморфизма или аллотропии. Различные кристаллические формы одного вещества называются полиморфными или аллотропическими модификациями (таблица 2.1).
Таблица 2.1Аллотропические модификации металлов
| Металл | Группа | Модификация | Кристаллическая решетка | |||
| Кальций | II-A | Сaa до 450 Caab 450-851 | Кубическая гранецентрированная Гексагональная плотноупакованная | |||
| Галлий | III-B | Gaa Gab | Ромбическая Тетрагональная | |||
| Таллий | III-B | Tla до 262 Tlb 262-304 | Гексагональная плотноупакованная Кубическая объемноцентрированная | |||
| Титан | IV-A | Tia до 882 Tib 882-1725 | Гексагональная плотноупакованная Кубическая объемноцентрированная | |||
| Цирконий | IV-A | Zra до 862 Zrb 862-1830 | Гексагональная плотноупакованная Кубическая объемноцентрированная | |||
| Гафний | IV-A | Hfa до 1610 Hfb 1610-1952 | Гексагональная Кубическая объемноцентрированная | |||
| Олово | IV-B | Sna до 18` Snb 18-232 | Алмазная Тетрагональная объемноцентрированная | |||
| Вольфрам | VI-A | Wa до 650 Wb 650-3400 | Кубическая объемноцентрированная Сложная (нерасшифрованная) | |||
| Уран | VI-A | Ua до 660 Ub 660-770 Ug 770- 1133 | Ромбоэдрическая Тетрагональная Кубическая объемноцентрированная | |||
| Марганец | VII-A | Mna до 742 Mnb 742-1080 Mng 1080-1180 Mnd 1180-1242 | Кубическая сложная «« Тетрагональная гранецентрированная Неизвестна | |||
| Железо | VIII | Fea до 910 1401-1539 Feg 910-1401 | Кубическая объемноцентрированная Кубическая гранецентрированная | |||
| Кобальт | VIII | Coa до 477 Cob 477-1490 | Гексагональная плотноупакованная Кубическая гранецентрированная | |||
Аллотропические формы обозначаются греческими буквами a, b, g и т.д., которые в виде индексов добавляют к символу, обозначающему элемент. Аллотропическая форма при самой низкой температуре, обозначается буквой a, следующая - b и т. д.
Явление полиморфизма основано на едином законе об устойчивости состояния с наименьшим запасом энергии. Запас свободной энергии зависит от температуры. Поэтому в одном интервале температур более устойчивой является одна модификация, а в другом – другая. Температура, при которой осуществляется переход из одной модификации в другую, носит название температуры полиморфного (аллотропического) превращения.
Механизм роста кристаллов новой фазы может быть нормальным кристаллизационным и мартенситным. Нормальный механизм роста – это зарождение новой фазы на границах зерен, блоков, фрагментов при малых степенях переохлаждения (Sna «Snb).
Мартенситный механизм реализуется при низких температурах и большой степени переохлаждения, при малой диффузионной подвижности атомов путем их сдвига (смещения) по определенным кристаллографическим плоскостям и направлениям. Новая фаза имеет форму игл и растет очень быстро (Coa «Cob).
Аллотропическое превращение сопровождается изменением свойств, объема и появлением внутренних напряжений.
3. КРИСТАЛЛИЗАЦИЯ МЕТАЛЛОВ И СПЛАВОВ
3.1. Энергетические условия процесса кристаллизации
В зависимости от температуры любое вещество (система) может быть в твердом, жидком или в газообразном состояниях. В физической химии системой называют совокупность индивидуальных веществ (химические элементы, независимые химические соединения), между которыми или частями которых обеспечена возможность обмена энергией, а также процессов диффузии.
Вещества, которые образуют систему, называются компонентами системы. Компоненты в системе присутствуют в разных фазах.
Фазой называется однородная часть системы, ограниченная от других частей системы поверхностью раздела, при переходе через которую свойства изменяются скачком.
Процесс перехода из жидкого или газообразного состояния в твердое, в результате чего образуется кристаллическая решетка и возникают кристаллы, называется кристаллизацией.
Чем объясняется существование при одних температурах жидкого, а при других температурах твердого состояния и почему превращение происходит при строго определенных температурах?
В природе все самопроизвольно протекающие превращения, а следовательно, кристаллизация и плавление обусловлены тем, что новое состояние в новых условиях является энергетически более устойчивым, обладает меньшим запасом энергии.
Энергетическое состояние системы, имеющей огромное число охваченных тепловым движением частиц (атомов, молекул), характеризуется особой термодинамической функцией (F), называемой свободной энергией, которая определяется:
F= U – TS,
где U – внутренняя энергия системы;
Т - абсолютная температура;
S - энтропия
Можно сказать, что чем больше свободная энергия системы, тем система менее устойчива, и если имеется возможность, то система переходит в состояние, где свободная энергия меньше.
С изменением внешних условий, например температуры, свободная энергия системы изменяется по сложному закону, но различно для жидкого и твердого состояний (рис. 3.1).

Рис. 3.1. Изменение свободной энергии жидкого и кристаллического состояний в зависимости от температуры
Выше температуры Тs меньшей свободной энергией обладает вещество в жидком состоянии, ниже Ts – вещество в твердом состоянии. Следовательно, выше Ts вещество должно находиться в жидком состоянии, а ниже Ts – в твердом, кристаллическом.
Очевидно, что при температуре, равной Ts свободные энергии жидкого и твердого состояний равны, металл в обоих состояниях находится в равновесии. Эта температура Ts и есть равновесная или теоретическаятемпература кристаллизации. Однако, при Ts Fж = Fкр, и процесс кристаллизации (плавления) не может идти, так как при равенстве свободных энергий обеих фаз плавление (кристаллизация) не будут сопровождаться уменьшением свободной энергии.
Для начала кристаллизации необходимо, чтобы процесс был термодинамически выгоден системе и сопровождался уменьшением свободной энергии системы. Их кривых (рис. 3.1) видно, что это возможно только тогда, когда жидкость будет охлаждена ниже точки Ts.
Температура, при которой практически начинается кристаллизация, может быть названа фактической температурой кристаллизации.
Охлаждение жидкости ниже температуры кристаллизации называется переохлаждением.
Обратное превращение из кристаллического состояния в жидкое может произойти только выше температуры Ts, это явление называется перенагреванием.
Величиной или степенью переохлаждения называют разность между теоретической и фактической температурами кристаллизации T = Ts - Tф.
Процесс перехода металла из жидкого состояния в кристаллическое можно изобразить кривыми в координатах время – температура (рис. 3.2).
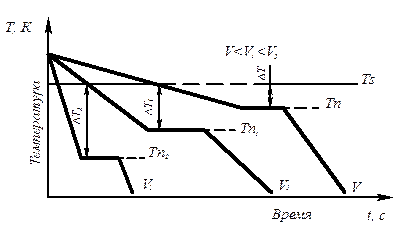
Рис. 3.2. Кривые охлаждения, полученные при кристаллизации металла
Охлаждение металла в жидком состоянии сопровождается плавным понижением температуры и может быть названо простым охлаждением, так как при этом нет качественного изменения состояния. При достижении температур кристаллизации на кривой температура – время появляются горизонтальные площадки (рис.3.2), так как отвод тепла компенсируется выделяющейся при кристаллизации скрытой теплотой кристаллизации.
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 534; Нарушение авторских прав?; Мы поможем в написании вашей работы!