
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Конфигурация, конформация, хиральность
|
|
|
|
Пространственное строение органических молекул
План:
1.Строение и конфигурация органических молекул
2.Стереоизомерия: а) геометрическая, б) оптическая
3.Конформация органических молекул: а) ациклическая, б) карбоциклическая, в) конденсированных кальциевых систем.
Каждое органическое вещество рассматривается в трёх аспектах: с точки зрения химического строения, конфигурации, конформации.
Строение – последовательность химических связей атомов в молекуле. Последовательность расположения атомов чрезвычайно важна в молекулах органических веществ, имеющих один и тот же химический состав, т.е. когда речь идёт об изомерах, изомерии. Строение предполагает, что все связи находятся в одной плоскости, но при изображении строения молекулы на плоскости бумаги теряется представление об её истинном положении в пространстве, например: атом углерода находится в sр3-гибридизации, имеет тетраэдрическое строение и все его заместители расположены под углом 109,50. если соединение содержит такой атом углерода в своей структуре, то атомы молекулы не лежат в одной плоскости, она имеет определённую конфигурацию – пространственное расположение атомов или групп атомов. При графическом изображении конфигурации молекулы этана две связи, лежащие в плоскости, обозначаются прямыми линиями
(строение этана).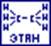
Зачернённый клин обозначает связь, выходящую из плоскости проекции и направленную к наблюдателю. Заштрихованный клин (или пунктирные линии) обозначает связь, выходящую из плоскости проекции и направленную от наблюдателя. Конфигурация этана может быть представлена в следующем виде: 
Стереоизомерия
Область химии, занимающаяся изучением пространственного атома и атомных групп, называется стереохимией. Стереохимия рассматривает трёхмерные структуры молекул относящиеся к строению, конфигурации и конформации.
Различают стереоизомерию двух типов: а) геометрическую, б) оптическую.
Геометрическая изомерия (или цис-транс-изомерия) предполагает наличие в органических веществах двойной связи – речь идёт об ациклических соединениях (может встретиться и в некоторых циклических соединениях, когда два заместителя могут иметь различную ориентацию относительно друг друга, и возможны цис- и трансизомеры).
Двойная углерод-углеродная С=С связь, вносит в молекулу значительную степень жидкости. Относительно свободное вращение, возможное вокруг простой связи не происходит в случае двойной связи.
Приставка “цис” даётся тому геометрическому изомеру, у которого одинаковые заместители находятся по одну сторону двойной связи, а приставка “транс” тому, у которого они находятся накрест по отношению к двойной связи (малеиновая и фумаровая кислоты). 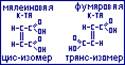
Эти два геометрических изомера реально существуют и отличаются различными физическими и химическими свойствами (температура кипения, плавления: малеиновая – 1300С; фумаровая – 2870С). (превращение этих кислот в малеиновый ангидрид).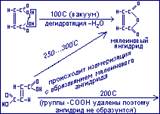
Среди причин, вызывающих заболевание псориаз, следует назвать нарушении процесса изомеризации этих двух кислот. Эфиры фумаровой кислоты используют для лечения псориаза.
Оптическая активность – это свойство органических веществ вращать плоскость поляризованного света. Далеко не все органические вещества обладают оптической активностью. Причина оптической активности – ассиметрическое строение молекул, т.е. наличие ассиметрических атомов углерода в органических веществах.
Ассиметрический атом углерода – это такой атом, который соединён с четырьмя различными атомами или группой атомов. С оптической активностью также связан термин хиральности, – явление, при котором молекула не может быть совмещена со своим зеркальным отражением, т.е. она не имеет элементов симметрии – или плоскости, или центров симметрии. Термин происходит от греч. hiros – рука: совместить ладони рук в одной плоскости не возможно.
Оптический изомер характеризуется триадой: ассиметрический атом  хиральность
хиральность  оптическая активность.
оптическая активность.
Описывая хиральность обозначают конфигурацию молекулы. Различают абсолютную и относительную конфигурацию. Относительная конфигурация выводится путём сравнения с эталоном (D- и L-глицериновым альдегидом).
Все стереоизомеры принято писать проекционными формулами Фишера, учитывая правила:
1.проекционные формулы пишут вертикально
2.наиболее окисленный атом углерода располагают сверху.
3.вертикальные связи, направленные от наблюдателя, обозначают пунктиром, а направленные к наблюдателю – прямой линией.
4.асимметрический атом углерода, как правило, не пишут
(D и L глицериновый альдегид)
.
Если в эталоне атом Н слева, а группа ОН справа, то это D-глицериновый альдегид, если же расположение атома и атомной группировки противоположное, это L-глицериновый альдегид.
Оптический эффект (способность раствора вращать плоскость поляризованного света) – это объективный фактор (свойство), обусловленный природой вещества: он определяется экспериментальным путём в поляриметре. Правосторонний эффект обозначается знаком “+”, а левостороннее вращение “-”. Не всегда имеет место совпадение стороны проявленного оптического эффекта и принадлежности к раду, например: в молочной кислоте. D- и L-молочная кислота  имеют одинаковые физические и химические свойства, а отличаются по оптическим свойствам (стороны оптического эффекта), они – энантиомеры.
имеют одинаковые физические и химические свойства, а отличаются по оптическим свойствам (стороны оптического эффекта), они – энантиомеры.
Энантиомеры – это изомеры, имеющие одинаковые физические (кроме знака вращения) и химические свойства, относящиеся друг к другу как предмет его зеркальному отражению. Абсолютная конфигурация определяется с помощью различных способов, например: методом рентгеноструктурного анализа определяют реальное расположение атомов в пространстве. Данные определения абсолютной конфигурации совпадают с относительной конфигурацией, поэтому повседневно используются удобной относительной конфигурацией.
Конформация
Конфигурация молекул – это фиксированное расположение атомов или групп атомов относительно друг друга в пространстве. Однако большинство молекул может находиться в нескольких взаимовращающихся формах или конформациях, переход между которыми происходит без разрыва связи. Конформация – следующий аспект трёхмерности структуры молекул.
Конформации – это существование нескольких геометрических форм одного и того же вещества, самопроизвольно, с большой скоростью превращающихся друг в друга угла и длинны связей вследствие свободного вращения атомных группировок во круг  -связей (С-С,N-N, C-N). Такие изомеры (формы) называют конформерами или поворотными изомерами. Существуют эти формы непродолжительное время. Вращение атомных групп вокруг
-связей (С-С,N-N, C-N). Такие изомеры (формы) называют конформерами или поворотными изомерами. Существуют эти формы непродолжительное время. Вращение атомных групп вокруг  -связи постоянно. Между временем существования и стабильностью конформера существует прямая зависимость. Есть термин – заторможенная конформация конформера, т.е. существование её более продолжительно (две конформации этана).
-связи постоянно. Между временем существования и стабильностью конформера существует прямая зависимость. Есть термин – заторможенная конформация конформера, т.е. существование её более продолжительно (две конформации этана). В конформации “заслонённая” при рассмотрении вдоль связи С-С атомы водорода ближайшей СН3-группы будут “заслонять” атомы водорода второй, удалённой, СН3-группы. В конформации “заторможенная” атомы водорода СН3-группы расположены в промежутках между атомами водорода первой СН2-группы. Такую конформацию называют заторможенной. Для более наглядного изображения конформаций пользуются проекционными формулами Ньюмена.
В конформации “заслонённая” при рассмотрении вдоль связи С-С атомы водорода ближайшей СН3-группы будут “заслонять” атомы водорода второй, удалённой, СН3-группы. В конформации “заторможенная” атомы водорода СН3-группы расположены в промежутках между атомами водорода первой СН2-группы. Такую конформацию называют заторможенной. Для более наглядного изображения конформаций пользуются проекционными формулами Ньюмена.
При построении формулы Ньюмена на молекулу смотрит вдоль углеродной связи, с “торца”, так что два атома углерода видны один позади другого 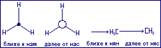 , (конформации этана, проекции Ньюмена).
, (конформации этана, проекции Ньюмена).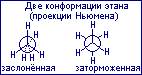
В центре рисунка на пересечении трёх сходящихся прямых, находится атом углерода приближённой к нам метильной группой. Связи С-Н второй, удалённой группы СН3 “выглядывают” из-за круга. Для пере хода этана из заторможенной конформации в заслонённую необходимо затратить примерно 12,5 кДж/моль энергии. Такой незначительный энергетический барьер не позволяет выделять отдельные поворотные изомеры. В каждой молекуле постоянно совершаются превращения из одной конформации в другую. Хорошо известно, что молекулы с меньшей внутренней энергией обладают большей устойчивостью. Из числа поворотных изомеров более устойчивыми, более энергетически выгодными, являются заторможенные: в этих положениях внутреннее вращение вокруг одинарных связей как бы тормозится, отсюда название – заторможенные.
Одна из форм наименее устойчива, другие более стойкие, при этом заместители заслоняют друг друга (одновременно увеличиваются силы отталкивания). Заслонённая конформация менее устойчива. Для обозначения конформаций используют условное обозначение угла (в единицах, кратных 600), который указывает на взаимную ориентацию СН3-групп.
Заместители в этой форме удалены друг от друга, силы отталкивания и потенциальная энергия меньше. Такая конформация называется заторможенной – энергетически выгодной и более стабильной. Разделение на подобные формы относительно, поскольку выделить их в чистом виде практически не возможно (заторможенная конформация).
Рассмотрим заторможенные конформации н-бутана (заслонённая не стабильная). Наиболее стабильными конформациями н-бутана является скошенная (гош) и трансоидная (анти), причём трансоидная (анти) немного более стабильна, потому что в ней две метильные группы расположены так далеко друг от друга, как только возможно.
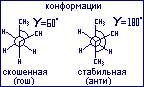
Эти конформации характерны для небольших структур. Начиная с пяти атомов углерода и больше ациклические углеводороды могут иметь следующие конфигурации: (клешневидная, зигзагообразная, нерегулярная).

Наиболее выгодной конфигурацией является клешневидная.
Конфигурации циклических углеводородов
Циклы по величине делят на:
· малые (3-4 атома углерода)
· обычные (5-7 атомов углерода)
· средние (8-10 атомов углерода)
· макроциклы (более 10 атомов углерода)
Простейшим представителем циклических углеводородов является циклопропан. Это крайне нестойкое соединение в связи с тем, что циклопропан подвержен двум видам напряжения (циклопропан). 
Угловое (Байеровское) напряжение – это увеличение энергии молекулы в результате отклонения угла геометрической фигуры от идеальной величины идеального угла в 109,50, что и обуславливает нестабильность молекулы. 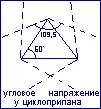
Первую попытку объяснить устойчивость циклов особенностями их строения сделал в 1885г. А.Байер. в основу своей теории напряжения автор положил тетраэдрическую модель атома углерода. Всякое отклонение валентных связей от нормального расположения (109,50) создаёт “напряжение” в углеродной цепи молекулы, а, следовательно, понижает её устойчивость. Напряжение определяют как разность между тетраэдрическим углом и углом геометрической фигуры, образованной атомами углерода в соответствующем цикле.
Торсионное (подорожное) напряжение – это увеличение энергии молекулы в результате пребывания в заслонённой конформации – атомные группы сближены и имеют место отталкивания атомов. Это дополнительный фактор, создающий неустойчивость трёхчленного цикла.
Ядро циклогексана содержится в различных биологически активные веществах – гормонах, витаминах. Поэтому важно знать его конформацию в плане прогнозирования устойчивости. Следует отметить, что согласно теории Байера у шестичленного и высших циклов устойчивость должна падать, а в действительности шестичленный цикл прочнее пятичленного. Здесь теория Байера пришла в противоречие с фактом. Это объясняется тем, что в основу Байер положил идею о плоско строении циклов, а в настоящее время установлено, что вполне плоским является только трёхчленный цикл (три его точки всегда лежат в одной плоскости). В циклогексане атомы углерода находятся в состоянии sp3-гибридизации, т.е. углеродные атомы имеют тетраэдрическое расположение. Если бы у циклогексана была плоская структура, действовало бы байеровское (угловое) и торсионное напряжения, и молекула была бы нестабильна, но циклогексан самый стойкий. Это связано с тем, что его молекула не плоская. У циклогексана шесть атомов углерода находятся в разных плоскостях, что обуславливает существование нескольких энергетически выгодных конформаций (кресло, ванна, свёрнутая (твист)). 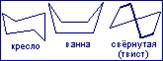
Экспериментально установлено, что наиболее стабильна конформация “кресло” (наименьшая энергия), в которой отсутствуют угловое напряжение и напряжение заслонения, т.е. углы не отклоняются от тетраэдрических, а атомы водорода соседних метиленовых групп находятся на значительном удалении друг от друга. Если в циклогексан вводить заместители, его производные будут отличаться по стабильности, т.к. связи в циклогексане неодинаковы:
· аксиальные – связи, направленные вверх и вниз от плоскости кольца и параллельно оси симметрии.
· Экваториальные – связи, расположенные радиально, под углом 190,50 к оси симметрии

Заместители, расположенные экваториально, придают производному циклогексана стабильность, а расположенные аксиально дестабилизируют его. В случае аксиального расположения заместителей возможно 1,3-диаксиальное взаимодействие при этом атомы отталкиваются друг от друга и молекула будет при этом не стабильна. С увеличением объёмности заместителей и их числа, как правило, их расположение всегда экваториально.
Олигосахариды
Олигосахариды иначе называются сахароподобными сложными углеводами, т.к. это кристаллические вещества, легко растворимые в воде, часто обладающие сладким вкусом. В зависимости от числа молекул моносахаридов, образующихся при их гидролизе, олигосахариды подразделяют на дисахариды, трисахариды, тетрасахариды и т.д.
Дисахариды – природные вещества, которые находятся в плодах, овощах и образуются при частичном гидролизе полисахаридов. Существуют так же и синтетические методы их получения. В клетках и биологических жидкостях дисахариды находятся как в свободном виде, так и в составе смешанных белковых комплексов. Все дисахариды строятся как гликозиды, т.е. молекула воды выделяется при взаимодействии двух ОН-групп молекул моносахаридов с обязательным участием полуацетального (гликозидного) гидроксила. По строению и химическим свойствам дисахариды делят на два типа.
Соединения первого типа – это дисахариды, образующиеся за счёт выделения воды из полуацетального гидроксила одной молекулы моносахарида, и одного из спиртовых гидроксилов другой. Эти сахариды имеют один полуацетальный гидроксил. По свойствам они аналогичны моносахаридам, в частности, они могут восстанавливать такие окислители, как оксиды серебра и меди, и поэтому их называют восстанавливающими дисахаридами. Дисахарид восстанавливающего типа рассматривают как моносахарид, в котором один спиртовой атом водорода замещён гликозидным остатком.
Соединения второго типа образуются так, что вода выделяется за счёт полуацетальных гидроксилов обоих моносахаридов. В дисахаридах этого типа нет полуацетального гидроксила, и они называются невосстанавливающими дисахаридами.
Восстанавливающие дисахариды
Благодаря наличию в молекулах дисахаридов этого типа полуацетального гидроксила они так же, как моносахариды способны к таутамерным превращениям. Это проявляется в мутаротации растворов (изменение оптической активности, т.е. угла вращения плоскости поляризации света с течением времени).
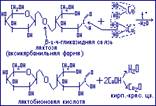
Важнейшие из восстанавливающих дисахаридов – мальтоза и лактоза.
Мальтоза (солодовый сахар) – представляет собой замещённую D-лактозу, содержащую в положении 4 остаток  ,D-глюкопиранозы, и поэтому мальтоза называется 4-(
,D-глюкопиранозы, и поэтому мальтоза называется 4-( ,D-глюкопиранозил)-D-лактозой. Для мальтозы возможны циклические (
,D-глюкопиранозил)-D-лактозой. Для мальтозы возможны циклические ( ,
, ) и открытая (оксикарбонильная) таутомерные формы.
) и открытая (оксикарбонильная) таутомерные формы.

Мальтоза (солодовый сахар) широко распространена в растительных и животных организмах. В промышленности её получают неполным гидролизом крахмала ферментами, содержащимися в солоде, т.е. в простых зёрнах злаков. Мальтоза выделена в кристаллическом состоянии, она хорошо растворима в воде, сбраживается дрожжами. В результате гидролиза мальтоза расщепляется на две молекулы глюкозы.
Лактоза (молочный сахар) представляет собой замещенную D-глюкозу, содержащую в положении 4 остаток  ,D-галактопиранозы, а именно 4-(
,D-галактопиранозы, а именно 4-( ,D-галактопиранозил)-D-глюкозу, содержит
,D-галактопиранозил)-D-глюкозу, содержит  -гликозидную связь. При гидролизе лактоза расщепляется на глюкозу и галактозу.
-гликозидную связь. При гидролизе лактоза расщепляется на глюкозу и галактозу.

Лактозу получают из молока: в коровьем молоке содержится до 5% лактозы, женское молоко содержит до 8,5% лактозы. В женском молоке лактоза связан с сиаловой кислотой, которая подавляет рост кишечных болезнетворных бактерий. С этим связаны целебные свойства грудного молока. Лактоза – компонент сложных липидов (ганглиозидов), входящих в состав ткани мозга и нервных волокон. Лактоза отличается от других сахаров отсутствием гигроскопичности: она не отсыревает. Молочный сахар применяют как фармацевтический препарат и как питание для грудных детей.
Химические свойства восстанавливающих дисахаридов
Будучи по своему строению гликозидами, дисахариды в присутствии кислот и ферментов легко гидролизуются с образованием двух молекул моносахаридов. Восстанавливающие дисахариды вступают в те же химические реакции, что и моносахариды: они мутаротируют в растворах, восстанавливаются до многоатомных спиртов, окисляются мягкими окислителями и гликобионовые кислоты проявляют свойства полуацеталей. Дисахариды являются многоатомными спиртами, а поэтому они растворяют гидроксид меди (II) с образованием синего окрашивания (качественные реакции на многоатомные спирты), образуют простые и сложные эфиры.
1. реакция полуацетального гидроксила.

2. реакция окисления мягкими окислителями.
3. реакция этерификации (фосфорилирования)

Невосстанавливающие дисахариды
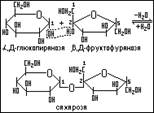
Сахароза (тростниковый или свекловичный сахар). Названия возникают в связи с её получением: либо из сахарной свеклы, либо из сахарного тростника. Тростниковый сахар был известен за много столетий до нашей эры. Лишь в середине 18 века этот сахарид был обнаружен в сахарной свекле и только в начале 19 века он был получен в производственных условиях. Сахароза очень распространена в растительном мире, лисья и семена всегда содержат небольшие количества сахарозы. Она содержится также и в плодах (абрикосах, персиках, грушах, ананасах). Её много в пальмовом и кленовом соках, кукурузе. Это наиболее известный и широко распространённый сахар.
В состав сахарозы входит разные молекулы моносахаридов:
1.  ,D-глюкопираноза
,D-глюкопираноза
2.  ,D-фруктофураноза:
,D-фруктофураноза:
тип связи 1,2-гликозидная
Оба моносахарида присутствуют в построении молекул сахарозы своими полуцетальными гидроксилами, т.е. у неё нет свободного полуацетального гидроксила.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 1453; Нарушение авторских прав?; Мы поможем в написании вашей работы!