
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Свойства энтропии
|
|
|
|
1) По характеру изменения энтропии можно судить о направлении процесса теплообмена.
Действительно, из выражения 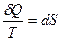 следует, что
следует, что 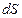 и
и 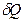 имеют один и тот же знак. Следовательно, если энтропия системы возрастает (
имеют один и тот же знак. Следовательно, если энтропия системы возрастает ( ), значит, ей сообщили какое-то количество теплоты (
), значит, ей сообщили какое-то количество теплоты (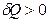 ); если энтропия убывает (
); если энтропия убывает ( ), значит, у нее отобрали теплоту (
), значит, у нее отобрали теплоту ( ).
).
2) Приращение энтропии в ходе процесса равно сумме приведенных количеств теплоты при обратимом процессе и больше этой суммы, если процесс необратим  .
.
 Рис.4.4
Рис.4.4
| Рассмотрим изменение энтропии в ходе цикла, состоящего из обратимой и необратимой ветвей (рис.4.4). Такой цикл в целом необратим, поэтому для него выполняется неравенство Клаузиуса (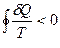 ): ):
|
 . (2.4.5)
. (2.4.5)
При обратимом процессе 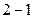 энтропия является функцией состояния, поэтому
энтропия является функцией состояния, поэтому
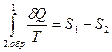 . и
. и 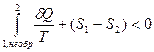 .
.
Следовательно, для необратимого процесса выполняется неравенство  ,
,
которое для любого процесса (и обратимого и необратимого) принимает вид
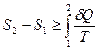 . (2.4.6)
. (2.4.6)
Для каждого элементарного процесса можно записать  . (2.4.7)
. (2.4.7)
3) Энтропия изолированной системы может только возрастать, если в ней протекают необратимые процессы, или оставаться постоянной, если процессы обратимы. Убывать энтропия не может: 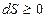 .
.
Изолированная (адиабатная) система не обменивается теплотой с окружающей средой ( 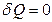 ). Следовательно, если адиабатный процесс обратим, то энтропия системы не изменяется:
). Следовательно, если адиабатный процесс обратим, то энтропия системы не изменяется: 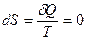 и
и  .
.
Объясняется это тем, что энтропия, подобно внутренней энергии, является аддитивной функцией состояния системы: энтропия системы равна сумме энтропий всех тел, входящих в состав системы. При передаче теплоты 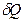 от тела
от тела 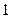 телу
телу  в обратимом процессе температуры обоих тел одинаковы (процесс равновесный). Поэтому изменение
в обратимом процессе температуры обоих тел одинаковы (процесс равновесный). Поэтому изменение 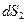 энтропии тела
энтропии тела  , получающего теплоту
, получающего теплоту 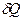 , равно и противоположно по знаку изменению
, равно и противоположно по знаку изменению 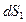 энтропии тела
энтропии тела 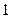 , отдающего теплоту
, отдающего теплоту 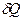 :
: 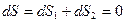 . (2.4.8)
. (2.4.8)
Если адиабатный процесс необратим, то 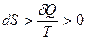 . (2.4.9)
. (2.4.9)
Обобщая эти формулы, можно записать 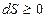 . (2.4.10)
. (2.4.10)
4) Обратимый адиабатный процесс является изоэнтропным (он протекает без изменения энтропии).
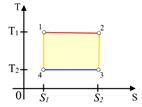 Рис.4.5
Рис.4.5
| Цикл Карно, состоящий из двух изотерм и двух адиабат, можно рассматривать как цикл, состоящий из двух изотерм и двух изоэнтроп. На  диаграмме (рис.4.5) он изображается в виде прямоугольника, стороны которого параллельны осям координат.
Из формулы диаграмме (рис.4.5) он изображается в виде прямоугольника, стороны которого параллельны осям координат.
Из формулы  следует, что теплота следует, что теплота 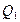 , полученная системой от нагревателя при протекании изотермического процесса , полученная системой от нагревателя при протекании изотермического процесса
|
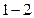 , равна:
, равна:  , (2.4.11)
, (2.4.11)
где  – энтропия системы в начале процесса,
– энтропия системы в начале процесса,  – энтропия в конце процесса.
– энтропия в конце процесса.
Теплота 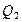 , отданная холодильнику в изотермическом процессе
, отданная холодильнику в изотермическом процессе 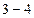 , равна
, равна
 . (2.4.12)
. (2.4.12)
Общее количество теплоты, полученной системой за цикл
 , (2.4.13)
, (2.4.13)
определяется площадью прямоугольника, заштрихованного на рисунке.
5) В табл.4.1 приведены выражения для изменения энтропии в различных процессах перехода идеальных газов из состояния 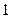 в состояние 2.
в состояние 2.
Таблица 4.1
Изохорный
( ) )
| Изобарный
( ) )
| Изотермический
( ) )
| Адиабатный
(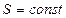 ) )
|
 , ,
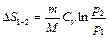
| 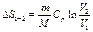
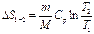
| 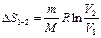
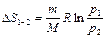
|
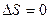
|
Они выведенные из формулы
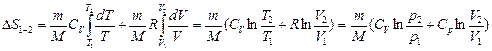 , (2.4.14)
, (2.4.14)
которая получена из выражения для изменения энтропии в равновесных процессах:
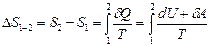 ,
,
где 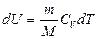 ,
, 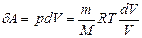 .
.
Для вывода формулы использованы выражения: 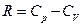 и
и 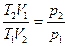 .
.
6) Энтропия является мерой связанной энергии.
В обратимом изотермическом процессе работа совершается за счет убыли свободной энергии 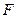 системы
системы 
или  , (2.4.15)
, (2.4.15)
где 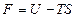 – свободная энергия системы (энергия Гельмгольца).
– свободная энергия системы (энергия Гельмгольца).
Величина 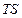 представляет собой ту часть внутренней энергии системы, которая не может быть превращена в работу в обратимом изотермическом процессе. Это как бы «обесцененная» часть внутренней энергии, которую часто называют связанной энергией. При одной и той же температуре величина связанной энергии тем больше, чем больше энтропия системы.
представляет собой ту часть внутренней энергии системы, которая не может быть превращена в работу в обратимом изотермическом процессе. Это как бы «обесцененная» часть внутренней энергии, которую часто называют связанной энергией. При одной и той же температуре величина связанной энергии тем больше, чем больше энтропия системы.
7) Энтропия является мерой вероятности состояния термодинамической системы.
Термодинамическая вероятность 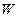 состояния системы определяется количеством способов реализации этого состояния. Или, иначе говоря, вероятность определенного макросостояния равна числу всевозможных микросостояний (микрораспределений частиц по координатам и скоростям, соответствующих данному состоянию), которыми оно может быть осуществлено. Термодинамическая вероятность
состояния системы определяется количеством способов реализации этого состояния. Или, иначе говоря, вероятность определенного макросостояния равна числу всевозможных микросостояний (микрораспределений частиц по координатам и скоростям, соответствующих данному состоянию), которыми оно может быть осуществлено. Термодинамическая вероятность 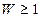 , поэтому она не является вероятностью в математическом смысле, которая
, поэтому она не является вероятностью в математическом смысле, которая  .
.
Больцман доказал, что между величиной термодинамической вероятности 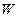 системы и величиной ее энтропии
системы и величиной ее энтропии  существует зависимость, которая называется формулой Больцмана:
существует зависимость, которая называется формулой Больцмана:  (2.4.16)
(2.4.16)
энтропия какого-либо состояния системы определяется логарифмом числа микросостояний, которыми это состояние может быть реализовано.
4.7. Второе начало термодинамики
Первое начало термодинамики, выражая закон сохранения и превращения энергии, не позволяет установить направление протекания термодинамических процессов. Оно не исключает возможности такого процесса, единственным результатом которого было бы превращение теплоты, полученной от некоторого тела, в эквивалентную ей работу. Например, первое начало допускает построение периодически действующего двигателя, совершающего работу за счет охлаждения одного источника теплоты (например, за счет внутренней энергии океанов). Такой двигатель называется вечным двигателем второго рода. Обобщение огромного экспериментального материала привело к выводу о невозможности построения вечного двигателя второго рода и получило название второго закона (второго начала) термодинамики.
Существует несколько эквивалентных друг другу формулировок второго закона термодинамики. Ограничимся следующими двумя:
1) нельзя создать периодически действующую машину, которая бы все тепло переводила в работу 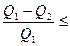
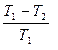 ; (2.4.17)
; (2.4.17)
2) теплота самопроизвольно переходит от тела с большей температурой к телу с меньшей температурой 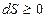 . (2.4.18)
. (2.4.18)
Первая формула содержит обе формулировки. Действительно, если 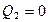 (машина не отдает тепло холодильнику), то
(машина не отдает тепло холодильнику), то  , следовательно,
, следовательно, 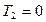 , но абсолютный нуль не достижим.
, но абсолютный нуль не достижим.
Если  (первое тело все полученное тепло отдает второму), то
(первое тело все полученное тепло отдает второму), то  , следовательно,
, следовательно, 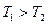 и
и  .
.
Второй закон термодинамики не является таким же всеобъемлющим и универсальным законом, как первый. Первое начало термодинамики – это частный случай закона сохранения энергии, примененный к тепловым процессам, поэтому он выполняется для всех систем и процессов без исключения. Второй закон может быть применен только к изолированным системам конечных размеров.
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 493; Нарушение авторских прав?; Мы поможем в написании вашей работы!