
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства. Ароматическое ядро, обладающее подвижной системой π-электронов, является удобным объектом для атаки электрофильными реагентами
|
|
|
|
Ароматическое ядро, обладающее подвижной системой π-электронов, является удобным объектом для атаки электрофильными реагентами. Этому способствует также пространственное расположение π-электронного облака с двух сторон плоского σ-скелета молекулы.
Для аренов наиболее характерны реакции, протекающие по механизму электрофилъного замещения, обозначаемого символом SE (от англ. substitution electrophilic).
Механизм реакции SE можно представить следующим образом:
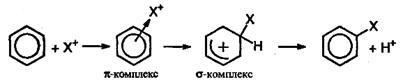
На первой стадии электрофильная частица X притягивается к π-электронному облаку и образует с ним π-комплекс. Затем два из шести π-электронов кольца образуют σ-связь между X и одним из атомов углерода. При этом ароматичность системы нарушается, т.к. в кольце остается только четыре π-электрона, распределенные между пятью атомами углерода (σ-комплекс). Для восстановления ароматичности σ-комплекс выбрасывает протон, а два электрона связи С-Н переходят в π-электронную систему.
 По механизму электрофильного замещения протекают следующие реакции ароматических углеводородов:
По механизму электрофильного замещения протекают следующие реакции ароматических углеводородов:
1. Галогенирование. Бензол и его гомологи взаимодействуют с хлором или бромом в присутствии катализаторов – безводных AlCl3, FeCl3,AlBr3 :
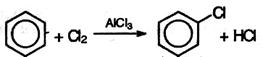
Из толуола по этой реакции получается смесь орто- и пара- изомеров (см. ниже). Роль катализатора заключается в поляризации нейтральной молекулы галогена с образованием из нее электрофильной частицы:
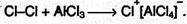
Нитрование. Бензол очень медленно реагирует с концентрированной азотной кислотой даже при сильном нагревании. Однако при действии нитрующей смеси (смеси концентрированных азотной и серной кислот) реакция нитрования проходит достаточно легко:
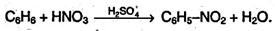
3. Сульфирование. Реакция легко проходит под действием «дымящей» серной кислоты (олеума):
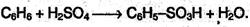
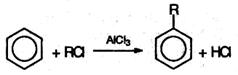
4. Алкилирование по Фриделю-Крафтсу:
5. Алкилирование алкенами. Эти реакции широко используются в промышленности для получения этилбензола и изопропилбензола (кумола). Алкилирование проводят в присутствий катализатора АlСl3.Механизм реакции сходен с механизмом предыдущей реакции:
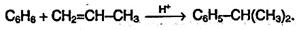
Все рассмотренные выше реакции протекают по механизму электрофильного замещения Se.
Наряду с реакциями замещения, ароматические углеводороды могут вступать в реакции присоединения, однако эти реакции приводят к разрушению ароматической системы и поэтому требуют больших затрат энергии и протекают только в жестких условиях:
6. Гидрирование бензола идет при нагревании и высоком давлении в присутствии металлических катализаторов (Ni, Pt, Pd). Бензол превращается в циклогексан:
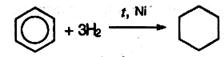
Гомологи бензола при гидрировании дают производные циклогексана:
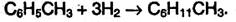
7. Радикальное галогенирование бензола происходит при взаимодействии его паров с хлором только под воздействием жесткого ультрафиолетового излучения. При этом бензол присоединяет три молекулы хлора и образует твердый продукт – гексахлорциклогексан (гексахлоран) СбН6Сlб:
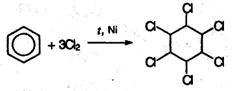
(атомы водорода в молекуле СбН6Сlб не указаны).
8. Окисление кислородом воздуха. По устойчивости к действию окислителей бензол напоминает алканы. Только при сильном нагревании (400 °С) паров бензола с кислородом воздуха в присутствии катализатора V2O5получается смесь малеиновой кислоты и ее ангидрида:
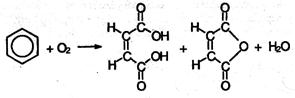
Гомологи бензола имеют ряд отличных от бензола химических свойств, связанных со взаимным влиянием алкильного радикала и бензольного кольца.
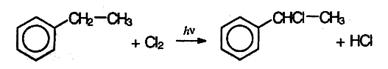
Реакции в боковой цепи. По химическим свойствам алкильные радикалы подобны алканам. Атомы водорода в них замещаются на галоген по радикальному механизму (SR). Поэтому в отсутствие катализатора при нагревании или УФ облучении идет радикальная  реакция замещения в боковой цепи. Влияние бензольного кольца на алкильные заместители приводит к тому, что в первую очередь замещается атом водорода у атома углерода, непосредственно связанного с бензольные кольцом (α-атома углерода).
реакция замещения в боковой цепи. Влияние бензольного кольца на алкильные заместители приводит к тому, что в первую очередь замещается атом водорода у атома углерода, непосредственно связанного с бензольные кольцом (α-атома углерода).
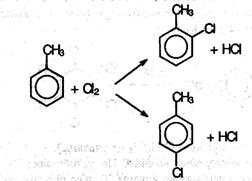
Замещение в бензольном кольце возможно только по механизму Se в присутствии катализатора (АlСl3 или FeCl3). Замещение в: кольце происходит в орто- и пара- положения по отношению к алкильному радикалу:
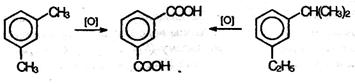
При действии перманганата калия и других сильных окислите лей на гомологи бензола боковые цепи окисляются. Какой бы сложной ни была цепь заместителя, она разрушается, за исключением он атома углерода, который окисляется в карбоксильную группу.
Гомологи бензола с одной боковой цепью дают бензойную кислоту:
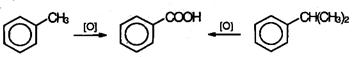
Гомологи, содержащие две боковые цепи, дают двухосновные кислоты:
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 421; Нарушение авторских прав?; Мы поможем в написании вашей работы!