
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реакции с разрывом связи О–Н
|
|
|
|
Химические свойства
Химические свойства спиртов определяются присутствием в их молекулах группы -ОН.
Связи С–О и О–Н сильно полярны и способны к разрыву. Различают два основных типа реакций спиртов с участием функциональной группы -ОН:
1) Реакции с разрывом связи О–Н: а) взаимодействие спиртов с щелочными и щелочноземельными металлами с образованием алкоголятов; б) реакции спиртов с органическими и минеральными кислотами с образованием сложных эфиров; в) окисление спиртов под действием дихромата или перманганата калия до карбонильных соединений. Скорость реакций, при которых разрывается связь О–Н, уменьшается в ряду: первичные спирты > вторичные > третичные.
2) Реакции, сопровождающиеся разрывом связи С–О: а) каталитическая дегидратация с образованием алкенов (внутримолекулярная дегидратация) или простых эфиров (межмолекулярная дегидратация); б) замещение группы –ОН галогеном, например при действии галогеноводородов с образованием алкилгалогенидов. Скорость реакций, при которых разрывается связь С–О, уменьшается в ряду: третичные спирты > вторичные > первичные.
Спирты – амфотерные соединения.
1. Кислотные свойства спиртов выражены очень слабо. Низшие спирты бурно реагируют со щелочными металлами:

но не реагируют со щелочами. С увеличением длины углеводородного радикала скорость этой реакции замедляется.
В присутствии следов влаги соли спиртов (алкоголяты) гидролизуются до исходных спиртов:

Это доказывает, что спирты – более слабые кислоты, чем вода.
2. При действии на спирты минеральных и органических кислот образуются сложные эфиры. Образование сложных эфиров протекает по механизму нуклеофильного присоединения-отщепления:
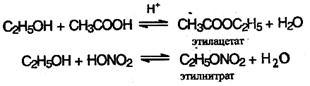
Отличительной особенностью первой из этих реакций является то, что атом водорода отщепляется от спирта, а группа ОН – от кислоты.
3) Спирты окисляются под действием дихромата или перманганата калия до карбонильных соединений. Первичные спирты окисляются в альдегиды, которые, в свою очередь, могут окисляться в карбоновые кислоты:

Вторичные спирты окисляются в кетоны:

Третичные спирты могут окисляться только с разрывом С–С связей.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 760; Нарушение авторских прав?; Мы поможем в написании вашей работы!