
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Орбитали двухатомной молекулы
|
|
|
|
1) Гомоядерные молекулы соответствуют второму ряду таблицы Менделеева:  . Следует заметить, что при образовании молекул перекрытие нижних слоев не дает молекулярной связи.
. Следует заметить, что при образовании молекул перекрытие нижних слоев не дает молекулярной связи.
2) Гетероядерные молекулы.
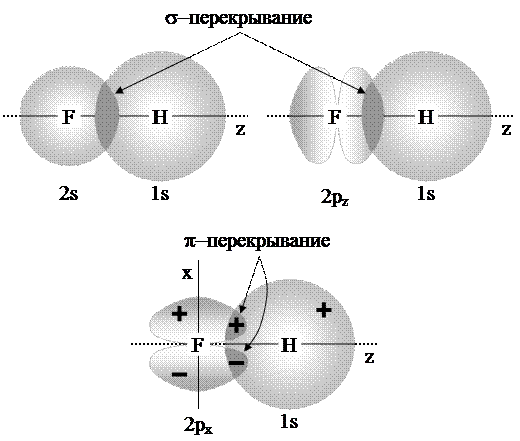
Молекула фторводорода  - простейший случай гетероядерной молекулы.
- простейший случай гетероядерной молекулы.
Электроотрицательность (т.е. мера притяжения электронов, которую проявляет атом, участвующий в ковалентной связи) 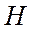 равна 2,1, а
равна 2,1, а 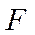 - 4,1.
- 4,1.
В молекуле 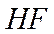 атом
атом 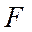 притягивает электроны значительно сильнее, чем атом
притягивает электроны значительно сильнее, чем атом  и связанные электроны уже не симметрично распределены между атомами, а смещены к атому фтора.
и связанные электроны уже не симметрично распределены между атомами, а смещены к атому фтора.
 |
Электронная конфигурация атома водорода -
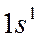 , атома фтора -
, атома фтора - , следовательно перекрытие с водородом идет по одной
, следовательно перекрытие с водородом идет по одной 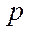 -орбитали:
-орбитали:  -взаимодействие
-взаимодействие  - и
- и  -орбиталей. Две другие орбитали фтора (
-орбиталей. Две другие орбитали фтора (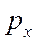 и
и  ) ориентированы перпендикулярно к оси связи и могут образовывать только
) ориентированы перпендикулярно к оси связи и могут образовывать только  -связи, для которых у водорода нет подходящих орбиталей. В результате мы получаем схему,
-связи, для которых у водорода нет подходящих орбиталей. В результате мы получаем схему,
где  и
и  - связывающая и разрыхляющая (антисвязывающая) молекулярные орбитали и не измененные орбитали фтора -
- связывающая и разрыхляющая (антисвязывающая) молекулярные орбитали и не измененные орбитали фтора - 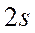 ,
,  и
и 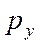 - несвязывающие орбитали.
- несвязывающие орбитали.
Связывающие  - орбитали заселены двумя электронами, и эти электроны имеют большую вероятность пребывания у атома
- орбитали заселены двумя электронами, и эти электроны имеют большую вероятность пребывания у атома  , чем у атома
, чем у атома 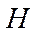 . Это означает, что связывающая орбиталь должна более походить на атомную
. Это означает, что связывающая орбиталь должна более походить на атомную 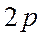 -орбиталь
-орбиталь 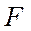 , чем на
, чем на  -орбиталь
-орбиталь  , т.е. вклад первой из них в молекулярную
, т.е. вклад первой из них в молекулярную 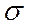 -орбиталь должен быть больше, чем второй. Поэтому атом
-орбиталь должен быть больше, чем второй. Поэтому атом 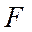 несет на себе некоторый отрицательный заряд, а атом
несет на себе некоторый отрицательный заряд, а атом 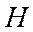 - такой же по величине положительный заряд и молекула фторводорода представляет собой диполь
- такой же по величине положительный заряд и молекула фторводорода представляет собой диполь 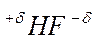 , где
, где  ,
,  - это степень ионности.
- это степень ионности.
Если  , то имеем ионную связь, которая является предельным случаем ковалентной связи.
, то имеем ионную связь, которая является предельным случаем ковалентной связи.
Если 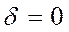 молекула будет симметричной и это соответствует предельному случаю чисто ковалентной связи.
молекула будет симметричной и это соответствует предельному случаю чисто ковалентной связи.
Все гетероядерные молекулы обладают дипольным моментом, который может быть измерен экспериментально.
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 338; Нарушение авторских прав?; Мы поможем в написании вашей работы!