
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Метод молекулярных орбиталей
|
|
|
|
Рассмотрим молекулу водорода с точки зрения метода молекулярных орбиталей.
Существуют 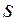 -орбитали,
-орбитали, 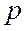 - орбитали,
- орбитали,  -орбитали и т.д. Для водородоподобных атомов:
-орбитали и т.д. Для водородоподобных атомов:
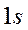 -орбиталь – это волновая функция
-орбиталь – это волновая функция  ,
,
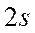 -орбиталь -
-орбиталь - 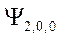 ,
,
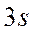 -орбиталь -
-орбиталь - 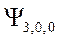 и т.д.,
и т.д.,
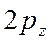 -орбиталь -
-орбиталь - 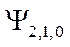 ;
;
 |
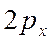 -орбиталь – это комбинация функций
-орбиталь – это комбинация функций  - это атомные орбитали.
- это атомные орбитали.
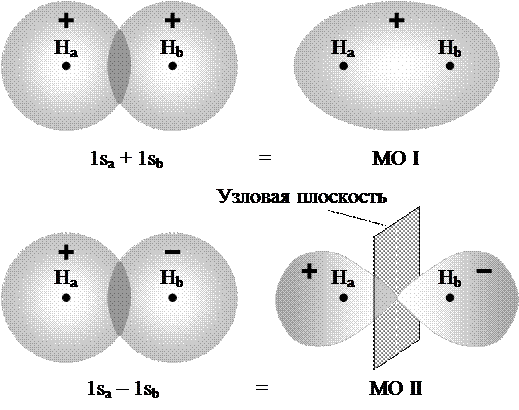
При сближении двух атомов водорода, находящихся в невозбужденном состоянии, 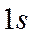 -орбитали начинают проникать друг в друга.
-орбитали начинают проникать друг в друга.
Возможны 2 варианта:
1. Если спины электронов антипараллельны, то волновые функции атомов перекрывают друг друга - положительное перекрывание атомных орбиталей - образовании связывающей молекулярной орбитали.
Энергия связывающей орбитали ниже исходных уровней энергии 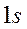 -атомных орбиталей
-атомных орбиталей
В соответствии с принципом минимума энергии в молекуле  в основном состоянии связывающая молекулярная орбиталь заселена двумя электронами.
в основном состоянии связывающая молекулярная орбиталь заселена двумя электронами.
 |
Энергия связи молекулы
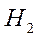 равна удвоенной разности энергий атомной орбитали
равна удвоенной разности энергий атомной орбитали  и связывающей молекулярной орбитали.
и связывающей молекулярной орбитали.
2. Если спины электронов сближающихся атомов водорода параллельны, то волновые функции атомов не перекрываются
Энергия соответствующей молекулярной орбитали, называемой разрыхляющей (антисвязывающей), лежит выше энергии  - атомной орбитали на столько же, на сколько ниже ее находится связывающая молекулярная орбиталь
- атомной орбитали на столько же, на сколько ниже ее находится связывающая молекулярная орбиталь
На двух молекулярных орбиталях может находиться от нуля до четырех электронов.
Один электрон на связывающей орбитали соответствует молекулярному иону  .
.
Ион  имеет 3 электрона и в соответствии с принципом Паули третий электрон должен размещаться на разрыхляющей орбитали.
имеет 3 электрона и в соответствии с принципом Паули третий электрон должен размещаться на разрыхляющей орбитали.
Разность между числом электронных пар на связывающих и антисвязывающих орбиталях, приходящаяся на одну связь, называется порядком (или кратностью) связи и является мерой прочности связи. Для молекулы 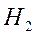 порядок связи равен 1. Экспериментально определенная энергия связи для этой молекулы составляет 436 кДж/моль. Молекулярные ионы
порядок связи равен 1. Экспериментально определенная энергия связи для этой молекулы составляет 436 кДж/моль. Молекулярные ионы 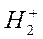 и
и 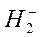 имеют порядок связи ½ и их энергии связи соответственно равны 265 и 17 кДж/моль.
имеют порядок связи ½ и их энергии связи соответственно равны 265 и 17 кДж/моль.
Связывающие и антисвязывающие орбитали, образованные 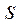 - и
- и 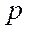 -электронами.
-электронами.
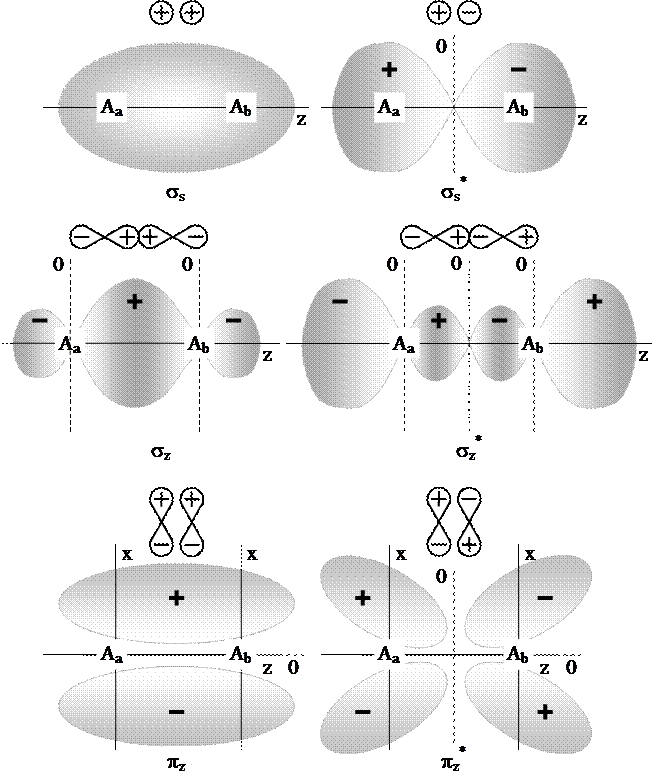
Минимальная энергия молекулы достигается лишь при определенном перекрытии атомных орбиталей.
Если АО перекрываются только одним лепестком, то говорят, что в молекуле осуществляется 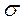 -связь. Связывающие (
-связь. Связывающие (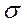 ) и антисвязывающие (разрыхляющие) (
) и антисвязывающие (разрыхляющие) (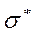 ) молекулярные орбитали, образованные
) молекулярные орбитали, образованные 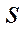 -электронами обладают аксиальной симметрией.
-электронами обладают аксиальной симметрией.
Если АО перекрываются двумя лепестками волновой функции говорят об образовании  -связи.
-связи.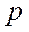 - и
- и  -атомные орбитали образуют как
-атомные орбитали образуют как 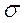 , так и
, так и 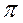 -молекулярные орбитали, совпадающие сами с собой при вращении вокруг оси связи на
-молекулярные орбитали, совпадающие сами с собой при вращении вокруг оси связи на  .
.
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 353; Нарушение авторских прав?; Мы поможем в написании вашей работы!