
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическая связь
|
|
|
|
Электронные конфигурации атомов
| N | Слой | l | Подслой | ml | Число АО | n, эл. |
| 1(К) | s | |||||
| 2(L) | s p | 1,0,–1 | ||||
| 3(М) | s p d | 1,0,–1 2,1,0,–1,–2 | ||||
| 4(N) | s p d f | 1,0,–1 2,1,0,–1,–2 3…0…–3 | ||||
| 5,6,7 | Аналогично |
Какой уровень заполняется дальше? 4s»3d по энергии. 4s n=3, d=2, сумма равна 5, n=4, s=0, сумма = 4, т.е. идет заполнение 4s и так далее. Энергия 5s » 4d, сумма равна 5 и 6 соответственно, следовательно, сначала заполняется 5s, затем 4d. Энергия 6s » 5d » 4f,сумма равна соответственно 6, 7 и 7. В начале заполняется 6s. Главное квантовое число меньше у 4f, следовательно, далее заполняется этот подуровень, а за ним 5d.
Электронная конфигурация атома записывается в виде формулы, где количество электронов на подуровне указывается верхним индексом. Например, для алюминия можно записать формулу электронной конфигурации в виде 1s22s22p63s23p1. Это означает, что на 1s, 2s, 2p, 3s, 3p-подуровнях находятся соответственно 2, 2, 6, 2, 1 электронов.
В многоэлектронном невозбужденном атоме электроны занимают орбитали с минимальными энергиями. Они взаимодействуют друг с другом: электроны, расположенные на внутренних энергетических уровнях экранируют (заслоняют) электроны, расположенные на внешних уровнях, от действия со стороны положительного ядра. Такое влияние определяет изменение последовательности возрастания энергии орбиталей по сравнению с последовательностью возрастания энергии орбиталей в атоме водорода.
Необходимо отметить, что для элементов с полностью или наполовину заполненными d - и f -подуровнями наблюдаются отклонения от данного правила. Например, в случае атома меди Сu. Электронной конфигурации [Аr] 3d104s1 соответствует меньшая энергия, чем конфигурации [Аr] 3d94s2 (символ [Аr] обозначает, что строение и заполнение внутренних электронных уровней такое же, как в аргоне). Первая конфигурация соответствует основному состоянию, а вторая – возбужденному.
Лекция 4, 5
§ 1. Природа химической связи. Теории для объяснения химической связи базируются на кулоновских, квантовых и волновых взаимодействиях атомов. Прежде всего, они должны объяснить выигрыш энергии при образовании молекул, механизм возникновения химической связи, ее параметры и свойства молекул.
Образование химической связи – процесс энергетически выгодный, сопровождается выделением энергии. Это подтверждено квантово-механическим расчетом взаимодействия двух атомов водорода при образовании молекулы (Гейтлер, Лондон). По результатам расчета выведена зависимость потенциальной энергии системы Е от расстояния между атомами водорода r (рис. 4.1).
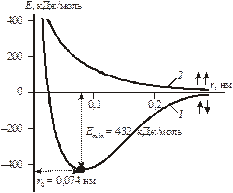
Рис. 4.1. Зависимость энергии от межядерного расстояния.
При сближении атомов между ними возникают электростатические силы притяжения и отталкивания. Если сближаются атомы с антипараллельными спинами, вначале преобладают силы притяжения, поэтому потенциальная энергия системы понижается (кривая 1). Силы отталкивания начинают преобладать при очень малых расстояниях между атомами (ядерные взаимодействия). При некотором расстоянии между атомами r0 энергия системы минимальна. Поэтому система становится наиболее устойчивой, возникает химическая связь и образуется молекула. Тогда r0 – межъядерное расстояние в молекуле Н2, которое и есть длина химической связи, а понижение энергии системы при r0 – энергетический выигрыш при образовании химической связи (или энергия химической связи Есв). Следует отметить, что энергия диссоциации молекулы на атомы равна Есв по величине и противоположна по знаку.
Для квантово-механического описания химической связи применяют два взаимодополняющих метода: метод валентных связей (ВС) и метод молекулярных орбиталей (МО).
§ 2. Метод валентных связей (ВС). Ковалентная связь. Основным универсальным типом химической связи является ковалентная связь. Рассмотрим механизм образования ковалентной связи по методу ВС (на примере образования молекулы водорода):
а) Ковалентная связь между двумя взаимодействующими атомами осуществляется за счет образования общей электронной пары. Каждый из атомов предоставляет на образование общей электронной пары один неспаренный электрон:
Н·+·Н ® Н: Н
Таким образом, по методу ВС химическая связь двухцентровая и двух-электронная.
б) Общая электронная пара может образоваться только при взаимодействии электронов с антипараллельными спинами:
Н+¯Н ® Н¯Н.
в) При образовании ковалентной связи происходит перекрывание электронных облаков:

Это подтверждено экспериментально определенным значением межъядерного расстояния в молекуле Н2, r=0,074 нм, что значительно меньше суммы радиусов двух свободных атомов водорода, 2r=0,106 нм.
В области перекрывания облаков электронная плотность максимальна, т.е. вероятность пребывания двух электронов в пространстве между ядрами значительно больше, чем в других местах. Возникает система, в которой два ядра электростатически взаимодействуют с парой электронов. Это приводит к выигрышу в энергии, и система становится более устойчивой, образуется молекула. Ковалентная связь тем прочнее, чем в большей степени перекрываются электронные облака.
Донорно-акцепторный механизм ковалентной связи. Образование ковалентной связи может происходить за счет собственной неподеленной пары электронов одного атома (иона) – донора и свободной атомной орбитали другого атома (иона) – акцептора. Такой механизм образования ковалентной связи называется донорно-акцепторным.
Образование молекулы аммиака NН3 происходит за счет обобществления трех неспаренных электронов атома азота и одного неспаренного электрона трех атомов водорода с образованием трех общих электронных пар. В молекуле аммиака NН3 у атома азота есть собственная неподеленная пара электронов. 1s–атомная орбиталь иона водорода Н+ не содержит электронов (вакантная орбиталь). При сближении молекулы NН3 и иона водорода происходит взаимодействие неподеленной электронной пары атома азота и вакантной орбитали иона водорода с образованием химической связи по донорно-акцепторному механизму и катиона NH4+. За счет донорно-акцепторного механизма валентность азота В=4.
Образование химических связей по донорно-акцепторному механизму – весьма распространенное явление. Так, химическая связь в координационных (комплексных) соединениях образуется по донорно-акцепторному механизму (см. лекцию 16).
Рассмотрим в рамках метода ВС характерные свойства ковалентной связи: насыщенность и направленность.
Насыщенность связи – это способность атома участвовать только в определенном числе ковалентных связей. Насыщенность определяется валентностью атома. Насыщенность характеризует количество (число) химических связей, образуемых атомом в молекуле, и это число называется ковалентностью (или, как в методе МО, порядком связи).
Валентность атома – понятие, широко используемое в учении о химической связи. Под валентностью понимают сродство, способность атома к образованию химических связей. Количественная оценка валентности при разных способах описания молекулы может отличаться. По методу ВС валентность атома (В) равна числу неспаренных электронов. Например, из электронно-ячеечных формул атомов кислорода и азота следует, что кислород двухвалентен (2s22p4), а азот трех валентен (2s22p3).
Возбужденное состояние атомов (в.с.). Спаренные электроны валентного уровня при возбуждении могут расспариваться, и переходить на свободные атомные орбитали (АО) более высокого подуровня в пределах данного валентного уровня. Например, для бериллия в невозбужденном состоянии (н.с.) В=0, т.к. на внешнем уровне нет неспаренных электронов. В возбужденном состоянии (в.с.) спаренные электроны 2s2 занимают 2s1 и 2p1 подуровни, соответственно – В=2.
Валентные возможности р-элементов одной группы могут быть неодинаковы. Это обусловлено неодинаковым числом АО в валентном уровне у атомов элементов, расположенных в разных периодах. Например, кислород проявляет постоянную валентность В=2, т.к. его валентные электроны находятся на 2 энергетическом уровне, где нет вакантных (свободных) АО. Сера в возбужденном состоянии имеет максимальную В=6. Это объясняется наличием вакантных 3d-орбиталей на третьем энергетическом уровне.
Направленность ковалентной связи. Пространственное строение молекул. Наиболее прочные химические связи возникают в направлении максимального перекрывания атомных орбиталей (АО). Поскольку АО имеют определенную форму и энергию, то их максимальное перекрывание возможно с образованием гибридных орбиталей. Гибридизация атомных орбиталей позволяет объяснить пространственное строение молекул. Поэтому ковалентная связь характеризуется направленностью.
§ 3. Гибридизация атомных орбиталей и пространственное строение молекул. Часто атомы формируют связи за счет электронов разных энергетических состояний. Так у атомов бериллия Ве (2s12р1), бора В (2s12р2), углерода С (2s12р3) в образовании связей принимают участие s- и р-электроны. Несмотря на то, что s- и р-облака отличаются по форме и энергии, химические связи, образованные с их участием, оказываются равноценными и расположены симметрично. Возникает вопрос, каким образом неравноценные по исходному состоянию электроны образуют равноценные химические связи. Ответ на него дает представление о гибридизации валентных орбиталей.
Согласно теории гибридизации химические связи формируют электроны не «чистых», а «смешанных», так называемых гибридных орбиталей. При гибридизации первоначальная форма и энергия орбиталей (электронных облаков) изменяются и образуются АО новой, но уже одинаковой формы и энергии. При этом число гибридных орбиталей равно числу атомных орбиталей, из которых они образовались.
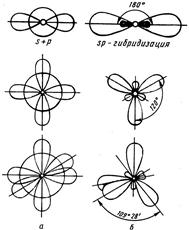
Рис. 4.2. Типы гибридизации валентных орбиталей.
Характер гибридизации валентных орбиталей центрального атома и их пространственное расположение определяют геометрию молекул. Так, при sр-гибридизации АО бериллия Ве возникают две sр-гибридные АО, расположенные под углом 180° (рис. 4.2), отсюда и связи, образуемые с участием гибридных орбиталей, имеют валентный угол 180°. Поэтому молекула ВеCl2 имеет линейную форму. При sр2-гибридизации бора В образуется три sр2-гибридных орбитали, расположенные под углом 120°. Вследствие этого молекула ВCl3 имеет тригональную форму (треугольник). При sр3-гибридизации АО углерода С возникает четыре гибридных орбитали, которые симметрично ориентированы в пространстве к четырем вершинам тетраэдра, поэтому молекула ССl4 имеет
также тетраэдрическую форму. Тетраэдрическая форма характерна для многих соединений четырехвалентного углерода. Вследствие sр3 гибридизации орбиталей атомов азота и бора тетраэдрическую форму имеют также NН4+и ВН4–.
Дело в том, что центральные атомы этих молекул, соответственно, атомы С, N и О образуют химические связи за счет sр3-гибридных орбиталей. У атома углерода на четыре sр3-гибридных орбитали приходится четыре неспаренных электрона. Это определяет образование четырех связей С-Н и расположение атомов водорода в вершинах правильного тетраэдра с валентным углом 109°28¢. У атома азота на четыре sр3-гибридных орбитали приходится одна неподеленная электронная пара и три неспаренных электрона. Электронная пара оказывается несвязывающей и занимает одну из четырех гибридных орбиталей, поэтому молекула Н3N имеет форму тригональной пирамиды. За счет отталкивающего действия несвязывающей электронной пары валентный угол в молекуле NH3 меньше тетраэдрического и составляет 107,3°. У атома кислорода на четыре sр3-гибридных орбитали приходится две несвязывающие электронные пары и два неспаренных электрона. Теперь уже две из четырех гибридных орбитали заняты несвязывающими электронными парами, поэтому молекула Н2О имеет угловую форму. Отталкивающее действие двух несвязывающих электронных пар проявляется в большей степени, поэтому валентный угол искажается против тетраэдрического еще сильнее и в молекуле воды составляет 104,5° (рис. 4.3.).
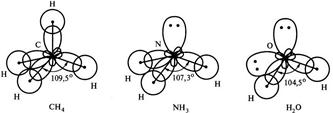
Рис. 4.3. Влияние несвязывающих электронных пар
центрального атома на геометрию молекул.
Таким образом, метод ВС хорошо объясняет нысыщенность и направленность химических связей, объясняет такие количественные параметры, как энергия (E) и длина химических связей (l), так и валентные углы (j) между химическими связями (строение молекул), что удобно и наглядно демонстрируется на шарико-стержневых моделях атомов и молекул. Метод ВС хорошо объясняет и электрические свойства молекул, характеризующиеся электроотрицательностью атомов, дипольным моментом молекул. Под электроотрицательностью атомов понимается их способность быть более положительными или отрицательными при образовании химической связи, или иными словами способностью притягивать или отдавать электроны, образуя анионы и катионы соответственно. Первая количественно характеризуется потенциалом ионизации (EП.И), вторая – энергия сродства к электрону (EС.Э).
Таблица 4.1
Пространственная конфигурация молекул и комплексов АВn
| Тип гибридизации центрального атома А | Число электронных пар атома А | Тип молекулы | Пространственная конфигурация | Примеры | |
| связы-вающих | несвязывающих | ||||
| sр | АВ2 | Линейная | BeCl2(г), CO2 | ||
| sр2 | АВ3 | Треугольная | BCl3, CO32– | ||
| АВ2 | Угловая | O3 | |||
| sр3 | АВ4 | Тетраэдрическая | CCl4, NH4, BH4 | ||
| АВ3 | Тригонально-пирамидальная | H3N, H3P | |||
| АВ2 | Угловая | H2O | |||
| sр3d | АН5 | Тригонально-бипирамидальная | PF5, SbCl5 | ||
| АВ4 | Искаженная тетраэдрическая | SF4 | |||
| АВ3 | Т-образная | ClF3 | |||
| АВ2 | Линейная | XeF2 | |||
| sр3d2 | АВ6 | Октаэдрическая | SF6, SiF62– | ||
| АВ5 | Квадратно-пирамидальная | IF5 |
Часто пользуются относительными шкалами электроотрицательности (ЭО) Полинга и Малликена, в последней ЭО есть полусумма EП.И и EС.Э. Значения их приведены в «Практикуме». ЭО по Полингу: H – 2,20; Li – 0,98; Be – 1,57;
Na – 0,93; Mg – 1,31; K – 0,82; B – 2,04; C – 2,55; N – 3,44; O – 3,44; F – 3,98;
Al – 1,61; Si – 1,90; P – 2,19; S – 2,58; Cl – 3,16.
Тем самым мы подходим к пониманию, что ковалентные связи могут быть полярными и неполярными, первые естественно реализуются за счет разных атомов. Более того, чем больше разница в ЭО атомов, тем связь полярнее, смещение электронной плотности вдоль оси химической связи в сторону более электроотрицательных атомов (F, O и др.) приводит к возникновению дипольного момента химической связи (m), равного М = q × r, где q – смещаемый заряд, r – расстояние между положительным и отрицательным зарядом. Ясно, что максимальный дипольный момент, например в ряду галогеноводородов будет у HF – 1,82 и убывает: HCl – 1,07, HBr – 0,79, HI – 0,38; для KF – 8,60. Принято говорить и оценивать полярность связи через выражение ионный характер связи или степень ионности, которую можно выразить в %. Так в молекулах HCl – 17%, а в KF – 83%. При этом следует помнить, что ионная связь имеет место только в кристаллах (NaCl, KF, NaBr), а в растворах имеет место электролитическая диссоциация и гидратация ионов. Но об этом ниже. Полярные молекулы являются диполями, т.е. системами, состоящими из двух равных по величине, но противоположных по знаку зарядов, находящихся на некотором расстоянии друг от друга. Длина диполя
отвечает диаметру атома и составляет 10–10 м, а заряд электрона  =1,6×10–19 Кл, поэтому электрический момент диполя близок к значению 10–29 Кл×м. Электрический момент диполя многоатомной молекулы равен векторной сумме электрических моментов диполей входящих в нее связей. Результат сложения зависит от пространственной структуры молекулы. Например, молекула СО2 имеет симметричное линейное строение за счет sр-гибридизации орбиталей атома углерода О=С=О. Хотя связи С=О имеют сильно полярный характер (m=2,7×10–29 Кл×м), вследствие взаимной компенсации дипольных моментов двух связей С=О молекула СО2 в целом неполярна. По этой же причине неполярны высокосимметричные тетраэдрические молекулы СН4, СF4, октаэдрический ион SiF62–. Напротив в молекуле Н2О полярные связи Н-О (m=1,58×10–28 Кл×м) располагаются под углом 104°30¢, поэтому электрические моменты двух связей О-Н взаимно не компенсируются и молекула воды является полярной (m=1,84×10–29 Кл×м).
=1,6×10–19 Кл, поэтому электрический момент диполя близок к значению 10–29 Кл×м. Электрический момент диполя многоатомной молекулы равен векторной сумме электрических моментов диполей входящих в нее связей. Результат сложения зависит от пространственной структуры молекулы. Например, молекула СО2 имеет симметричное линейное строение за счет sр-гибридизации орбиталей атома углерода О=С=О. Хотя связи С=О имеют сильно полярный характер (m=2,7×10–29 Кл×м), вследствие взаимной компенсации дипольных моментов двух связей С=О молекула СО2 в целом неполярна. По этой же причине неполярны высокосимметричные тетраэдрические молекулы СН4, СF4, октаэдрический ион SiF62–. Напротив в молекуле Н2О полярные связи Н-О (m=1,58×10–28 Кл×м) располагаются под углом 104°30¢, поэтому электрические моменты двух связей О-Н взаимно не компенсируются и молекула воды является полярной (m=1,84×10–29 Кл×м).
Неполярная ковалентная связь возникает в гомоядерных молекулах (состоящих из атомов одного элемента). Вследствие одинаковой электроотрицательности атомов в неполярных молекулах центры тяжести положительных и отрицательных зарядов совпадают. Область перекрывания электронных облаков расположена симметрично относительно двух атомов. Типичными неполярными молекулами являются простые газообразные молекулы неметаллов (О2, Н2, Cl2 и т.д.). За счет неполярной ковалентной связи образуются также и кристаллы простых неметаллических веществ, например, алмаз, кремний, германий.
§ 4. Метод молекулярных орбиталей (МО). Согласно методу МО молекула рассматривается как совокупность ядер и электронов, где каждый электрон движется в поле остальных электронов и ядер. Метод МО распространяет квантово-механические закономерности, установленные для атомов, на более сложную систему – молекулу. В основе метода МО лежит представление об «орбитальном» строении молекул, т.е. предположение о том, что все электроны молекулы распределяются по соответствующим молекулярным орбиталям (МО). Специфика молекулярных орбиталей в том, что они являются многоцентровыми. Общее число образующихся МО равно общему числу исходных АО.
Описать молекулу по методу МО – это значит определить тип молекулярных орбиталей, их энергию и выяснить характер распределения электронов по МО. Мы рассмотрим самый простой вариант метода МО, называемый линейной комбинацией атомных орбиталей, сокращенно ЛКАО.
Согласно методу МО ЛКАО, волновая функция молекулы y±AB представляет собой линейную комбинацию атомных волновых функций yA и yB,
y±AB = с1yA+с2yB, где c1, c2 – коэффициенты, учитывающие долю участия АО в образовании молекулы.
Связывающие и разрыхляющие МО. Рассмотрим форму и относительную энергию двухцентровых МО, возникающих при линейной комбинации двух s–AO. Процесс сложения и вычитания двух s–AO показан на рис. 4.4.
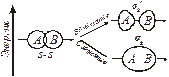
| 
|
| Рис. 4.4. Схема образования МО. | Рис. 4.5. Энергетическая схема АО и МО в системе из двух атомов водорода. |
При сложении АО образуется двухцентровая МО. Сложение означает, что МО характеризуется повышенной электронной плотностью в пространстве между ядрами и поэтому энергетически более выгодна, чем исходные АО. Такую МО называют связывающей и обозначают s S. При вычитании функций АО образуется МО, разъединенные области которой направлены в разные стороны от атомов. В этом случае электронная плотность между ядрами равна нулю. Такая МО называется разрыхляющей, она обозначается звездочкой – sS*.
Перекрывание электронных облаков может осуществляется различными способами (рис. 4.6).
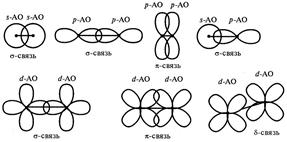
Рис. 4.6. Схема перекрывания АО.
1) s -связь возникает при перекрывании s-s, s-p, d-d облаков вдоль по осевой линии, соединяющей центры атомов (линии связи).
2) p -связи осуществляется при перекрывании py-py, pz-pz и d-d облаков в плоскости перпендикулярно линии связи.
3) d -связи возникает при перекрывании двух d облаков, расположенных в параллельных плоскостях, перпендикулярных линии связи.
Молекулы с кратными связями. p- и d- связи могут налагаться на s- связи, вследствие чего образуются молекулы с кратными связями. Например, два атома азота связаны в молекулу за счет трех ковалентных связей (NºN), одна из них s- связь, а две другие – p- связи. В линейной молекуле CO2 каждый из атомов кислорода соединяется с атомом углерода одной d- и одной p- связью:
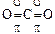 .
.
Наложением p- связей объясняется увеличение кратности связи в ряду:
C2H6 — C2H4 — C2H2
H3C–CH3 H2C=CH2 HCºCH
Образование МО из АО представляют также энергетической диаграммой (рис. 4.5). Горизонтальные линии по краям диаграммы соответствуют энергиям исходных АО, а в средней части – энергиям связывающих и разрыхляющих МО.
Электроны на связывающей и разрыхляющей МО оказывают противоположное влияние на стабильность молекул: каждая занятая электронами разрыхляющая МО компенсирует одну занятую связывающую МО. Поэтому порядок (кратность) связи можно определить следующим образом:

В отличие от метода ВС по методу МО в химической связи может участвовать нечетное число электронов: один, два, три и т.д. Допускается порядок связи, равный 1/2, 3/2, 5/2 и т.д. Чтобы из АО образовались МО, необходимы следующие условия: а) близкие значения энергии АО, б) значительное перекрывание АО, в) одинаковая симметрия АО относительно оси молекулы.
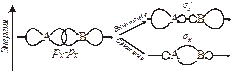
| 
|
| Рис. 4.7. Схема образования МО из рх-атомных орбиталей. | Рис. 4.8. Схема образования связывающей и разрыхляющей p-МО из рz-АО. |
АО могут взаимодействовать друг с другом с образованием МО по s-, p- и d-типу. Перекрывание по s-типу будет происходить при взаимодействии s-АО с образованием s S и s S * МО. Комбинация двух рх-АО происходит также по s-типу, при этом образуются sх-МО (связывающая) и s х *-МО (разрыхляющая) (рис. 4.7). По p-типу могут взаимодействовать р- и d-АО. При взаимодействии двух ру-АО возникает одна связывающая pу-МО и одна разрыхляющая pу*-МО. Аналогично, из двух рz-АО образуются pz-МО связывающая и pz*-разрыхляющая (рис. 4.8).
Электронные формулы некоторых молекул. Для элементов второго периода перекрывание 1s1 АО незначительно по сравнению с АО внешнего 2-го уровня, поэтому АО 1s1 считают несвязывающими. Переход электронов с АО на МО и их заполнение отражает энергетическая диаграмма молекулы О2 (рис. 4.9).

Рис. 4.9. Энергетическая диаграмма молекулы О2.
s-электроны второго уровня 2s1 перейдут с АО на МО с образованием  связывающей МО и s 2s * – разрыхляющей МО.
связывающей МО и s 2s * – разрыхляющей МО.
р-электроны перейдут с трех АО 2рх, 2ру, 2рz на МО с образованием 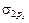 -связывающей, на которой размещаются два электрона с АО 2рх, затем с образованием двух p2р-связывающих МО, на которых размещаются четыре электрона С АО (2ру и 2рz). Последние два электрона С АО 2рz в соответствии с правилом Гунда разместятся по одному на двух s 2p * разрыхляющих орбиталях.
-связывающей, на которой размещаются два электрона с АО 2рх, затем с образованием двух p2р-связывающих МО, на которых размещаются четыре электрона С АО (2ру и 2рz). Последние два электрона С АО 2рz в соответствии с правилом Гунда разместятся по одному на двух s 2p * разрыхляющих орбиталях.
В Практикуме показано распределение электронов по МО для гомоядерных молекул элементов 2-го периода и даны количественные характеристики химической связи. Анализ этих данных позволяет сделать следующие выводы:
В ряду В2–С2–N2 по мере заполнения связывающих МО уменьшается межъядерное расстояние и увеличивается энергия диссоциации молекул, т.е. происходит упрочнение молекул.
В ряду N2–О2–F2 по мере заполнения разрыхляющих МО, напротив межъядерное расстояние возрастает, а энергия диссоциации уменьшается, следовательно, уменьшается стабильность молекул.
Удаление электрона с разрыхляющей орбитали приводит к возрастанию энергии диссоциации и уменьшению межъядерного расстояния (сравнение данных для молекулы О2 и иона О2+). Удаление электрона со связывающей МО, наоборот, приводит к уменьшению энергии диссоциации и возрастанию межъядерного расстояния, и уменьшению стабильности, о чем и свидетельствует сравнение данных для молекулы N2 и иона N2+.
Магнитные свойства молекул. Характер распределения электронов по МО позволяет объяснить магнитные свойства молекул. Собственный магнитный момент (парамагнетизм) молекул обусловлен наличием неспаренных электронов. В молекуле кислорода имеется два неспаренных электрона, поэтому она парамагнитна. Методом ВС парамагнетизм молекулярного кислорода объяснить не удается.
Строение гетероядерных молекул. Метод МО позволяет рассмотреть строение гетероядерных молекул, в состав которых входит два и более атомов различных элементов.
В молекуле СО (так же как и в молекуле N2) на внешнем уровне находится 10 электронов, в т.ч. 8 электронов на связывающих и 2 электрона на разрыхляющих МО. Порядок связи для молекул СО и N2 равен 3. Это обуславливает сходство в свойствах и параметрах молекул СО и N2.
Таким образом, метод МО успешно объясняет магнитные и оптические (спектральные) свойства различных молекул. Оба метода (МО и ВС) дополняют друг друга в описании химической связи молекул.
§ 4. Межмолекулярные взаимодействия. Силы взаимодействия между молекулами, впервые исследованные Ван-дер-Ваальсом, имеют в основном электрическую природу. Взаимодействия между молекулами разного типа различны как по величине (порядка 10 кДж), так и по происхождению сил межмолекулярного сцепления.
Так взаимодействие полярных молекул, обусловленное наличием у них дипольных моментов, характеризуется наибольшей величиной и заключается в ориентации электрических диполей, связанной с понижением энергии поля. Силы взаимодействия между полярными молекулами называются ориентационными.
При контакте полярных молекул с неполярными в последних возможно возникновение «наведенного», или индуцированного, дипольного момента и взаимодействие сведется к предыдущему случаю, но его силы, называемые индукционными, будут несколько меньше.
Неполярные молекулы взаимодействуют между собой за счет так называемых «мгновенных диполей», связанных с мгновенным перераспределением зарядов в неполярных молекулах. Как правило, взаимодействие между неполярными молекулами, называемое дисперсионным, значительно слабее рассмотренных выше взаимодействий.
Лекция 6
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 879; Нарушение авторских прав?; Мы поможем в написании вашей работы!