
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кислород
|
|
|
|
Электронная конфигурация невозбужденного атома кислорода 1s22s22р4:
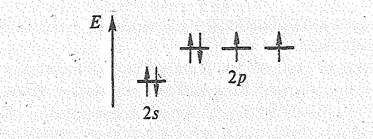
Подобно фтору, кислород образует соединения почти со всеми элементами (кроме гелия, неона и аргона). Поскольку по электроотрицательности кислород уступает только фтору, степень окисления кислорода в подавляющем большинстве соединений равна —2. Кроме того, кислород проявляет степени окисления +2 и +4, а также + 1 и –1 в соединениях со связью О—О.
Кислород — самый распространенный элемент (58,0 мол. доли) на Земле. Состоит из трех стабильных изотопов: 16О (99,759%), 17О (0,037%) и 18O (0,204%). Искусственно получены также изотопы 14O, 15O и 19О, период полураспада которых исчисляется десятками секунд. Вследствие количественного преобладания и большой окислительной активности кислород предопределяет форму существования на Земле всех остальных элементов. Его значение было особенно велико в период образования земной коры. Предполагается, что наличие кислорода в атмосфере обусловлено вторичными процессами деятельностью зеленых растений.
Простые вещества. Наиболее устойчива двухатомная молекула кислорода О2. Как показывают магнитные исследования, она парамагнитна. При этом величина ее парамагнетизма отвечает наличию двух непарных электронов:
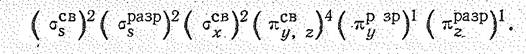

В молекуле О2 на 8 связывающих электронов приходится 4 разрыхляющих, поэтому порядок связи в ней равен двум. Учитывая парамагнетизм и порядок связи, строение молекулы О2 можно передать структурными формулами[1]:

Вследствие кратности связи межатомное расстояние в О2 (0,1207 нм) меньше длины одинарной связи 0—О (0,148 нм). По этой же причине молекула О2 весьма устойчива, ее энергия диссоциации равна 494 кДж/моль, в то время как энергия одинарной связи О–О всего 210 кДж/моль. Диссоциация молекул О2 на атомы становится заметной лишь при 2000°С; она имеет место также при поглощении ультрафиолетового излучения (фотолиз).
Температуры плавления (—218,9 °С) и кипения (—183 °С) кислорода очень низкие. Он плохо растворяется в воде (5 объемов О2 в 100 объемах Н2О при 0 °С). Жидкий и твёрдый кислород притягивается магнитом.
Аллотропическую модификацию кислорода озон О3 можно рассматривать как соединение О (IV).
Кислород обладает высокой химической активностью, особенно при нагревании и в присутствии катализатора; с большинством простых веществ он взаимодействует непосредственно, образуя оксиды; лишь по отношению к фтору проявляет восстановительные свойства.
Кислород получают ректификацией жидкого воздуха, а также как побочный продукт при электролизе воды. В лаборатории для его получения используют термическое разложение богатых кислородом соединений (КМnО4, КСlO3 и др.).
Соединения со степенью окисления кислорода —2. Как уже указывалось, образование двух- и многозарядных одноатомных анионов Эn- энергетически невыгодно. Поэтому не существует соединений, содержащих ион О2-. Даже в кристаллических оксидах наиболее активных металлических элементов типа Nа2O и СаО эффективный заряд атома кислорода составляет всего около 1—.
Как и для других р -элементов 2-го периода, максимальная валентность (число двухэлектронных двухцентровых связей) кислорода равна четырем. При этом атомы кислорода могут находиться в состоянии sр 3-, sр 2- и sр -гибридизации, что соответствует тетраэдрическому, треугольному и линейному расположению s–связей. В качестве примера соединений, в которых проявляются эти гибридные состояния орбиталей кислорода, можно указать соответственно кристаллические ВeО, ТiO2 и SiO2.
Весьма разнообразны также оксиды, в которых координационное число кислорода превышает значение его максимальной валентности, т. е. больше четырех. Например, в кристалле МgO координационное число кислорода равно шести, а в кристалле Nа2O восьми. Согласно теории молекулярных орбиталей это обусловлено тем, что в кристалле MgO (структурный тип NаСI) каждый атом О (за счет 2 p х-, 2 р y- и 2 р z-орбиталей) объединяется с шестью соседними атонами Мg посредством трех трехцентровых связей. Аналогично построены кристаллические МnО, FеО, СоО, NiO и другие оксиды со структурой типа NаСI.
В оксидах типа Nа2O (К2O, Rb2O, Li2O) атомы кислорода (за счет 2 s, 2 р x-, 2 p у- и 2 р z-орбиталей) с восемью соседними атомами металла объединяются посредством четырех трехцентровых связей.
Состав кристаллических оксидов (в особенности d -элементов) в большей или меньшей степени переменный. Так, для МnО он изменяется в пределах от МnО до МnО1.5, а для МnО2 — от МnO1,5 до МnО2,6. Если в оксидах содержание кислорода выше стехиометрического, они проявляют дырочную проводимость, а если содержание металла выше стехиометрического, то электронную. Полупроводниками с дырочной проводимостью являются МnО, Сu2О, FеО н др. Ряд оксидов, состав которых не подчиняется обычным правилам степеней окисления (например, Сr3О, Тi6О, Тi3О), — металлические соединения.
Важнейшим из оксидов является оксид водорода — вода. Достаточно сказать, что она составляет 50—99% массы любого живого существа. Кровь человека содержит более 4/5 воды, мускулы — 35% воды. При средней продолжительности жизни (70 лет) человек выпивает около 25 т воды.
Молекула воды имеет угловую форму, что согласно теории валентных связей соответствует sр 3-гибридвому состоянию атома кислорода. В молекуле Н2O две sр 3-гибридные орбитали атома кислорода участвуют в образовании двух связей О—Н. На двух других sр 3-гибридных орбиталях расположены две несвязывающие электронные пары. Валентный угол в молекуле воды НOН составляет 104,5о.
В рамках теории молекулярных орбиталей модель молекулы воды соответствует распределению восьми валентных электронов по двум связывающим и двум несвязывающим молекулярным орбиталям

и наличию двух свободных разрыхляющих орбиталей (рис. 1). Такое объяснение подтверждается наличием у молекулы Н2О четырех первых потенциалов ионизации (27,3; 16,2; 14,5 и 12,6 эВ).
 С позиций теории молекулярных орбиталей строение молекулы Н2О можно объяснить следующим образом. Взаимное расположение атомов водорода и кислорода в молекуле воды можно представить схемой:
С позиций теории молекулярных орбиталей строение молекулы Н2О можно объяснить следующим образом. Взаимное расположение атомов водорода и кислорода в молекуле воды можно представить схемой:

Рис 1. Энергетическая Молекулярные орбитали Н2О образуются за счет 2 s -,
диаграмма орбиталей и 2 р -орбиталей атома кислорода и 1 s -орбиталей
молекулы Н2О двух атомов водорода. Характер перекрывания этих
орбиталей показан на рис. 2.
Перекрывание 2 р x-орбитали атома кислорода и 1 s -орбиталей двух атомов водорода приводит к возникновению молекулярных sxсв.- и sхразр.-орбиталей, Как видно из рис. 2, характер перекрывания 2 s - и 2 р z-орбиталей кислорода одинаков. В результате образуются три молекулярные орбитали: связывающая ssсв., почти несвязывающая sz и разрыхляющая szразр.. Орбиталь 2 р y, расположенная перпендикулярно плоскости расположения атомов Н и О, с 1 s -орбиталями атомов Н не перекрывается и в молекуле Н2O играет роль не-связывающей молекулярной py -орбитали.

Рис. 2. Перекрывание 2 s -, 2 р z- и 2 р x-орбиталей атома кислорода с 1 s -орбиталями двух атомов водорода молекулы воды.
Таким образом, комбинация исходных четырех атомных орбиталей кислорода и двух орбиталей атомов водорода приводит к образованию двух связыазющнх (ssсв. и sxсв.), двух несвязывающих (sz и py) и двух разрыхляющих (sxразр. И szразр.) молекулярных орбиталей (см. рис. 1).
В соответствии с природой элемента в положительной степени окисления характер оксидов в периодах и группах периодической системы закономерно изменяется. В периодах уменьшается отрицательный эффективный заряд на атомах кислорода dо и осуществляется постепенный переход от основных через амфотерные оксиды к кислотным, например:
 Различие в свойствах оксидов разного типа проявляется при их взаимодействии с водой:
Различие в свойствах оксидов разного типа проявляется при их взаимодействии с водой:

 а также при взаимодействии оксидов разного типа друг с другом:
а также при взаимодействии оксидов разного типа друг с другом:
Амфотерные оксиды с водой не взаимодействуют, но могут реагировать и с кислотами, и с щелочами:

а при сплавлении — с основными и кислотными оксидами.
Сравнительную количественную оценку основно-кислотной активности оксидов можно дать на основании значений DG соответствующих однотипных реакций. Уменьшение отрицательного значения DGо298 в реакциях

свидетельствует об ослаблении в ряду Nа2О – МgО —Al2O3 их основных свойств, а также об их способности взаимодействовать с водой. В ряду Р2О5—SO3—Сl2О7

наоборот, наблюдается увеличение отрицательного значения DGо298, что свидетельствует об усилении у оксидов кислотных свойств.
Соединения перекисного типа. Сродство к электрону молекулы O2 составляет 0,8 эВ, а ее энергия ионизации 12,08 эВ. При химических превращениях молекула O2 может присоединять или терять электроны с образованием молекулярных ионов типа O22-, O2- и O2+ (табл. 1).
Таблица 1.
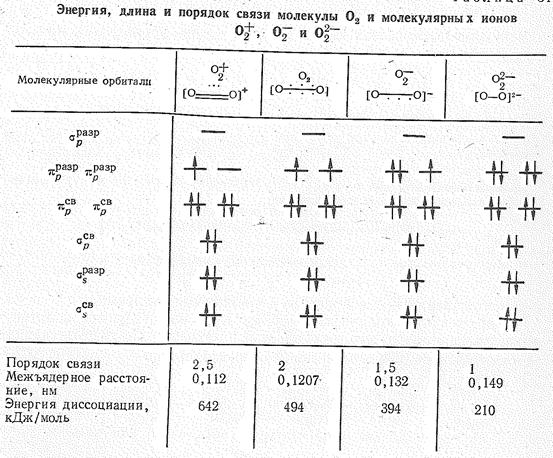
Как видно из табл. 1, удаление электрона с pразр. -орбитали молекулы О2 соответствует повышению порядка связи в О2+, а появление электронов на pразр -орбитали приводит, наоборот, к уменьшению порядка связи в молекулярных нонах О22- и О2-. В соответствии с этим в ряду О2+ – О2 — О2- — О22- расстояние между атомами кислорода увеличивается, а средняя энергия связи уменьшается.
Присоединение одного электрона к молекуле О2 вызывает образование надпероксид - нона О2- :
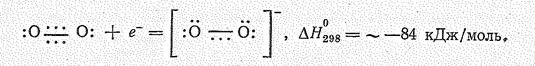
Производные радикала О2- называются надпероксидами; они известны для наиболее активных щелочных металлов (К, Rb, Сs). Надпероксиды образуются при прямом взаимодействии простых веществ:
К + O2 = КO2.
Непарный электрон нона О2- обусловливает парамагнетизм надпероксидов и наличие у них окраски. Надпероксиды — очень сильные окислители. Oни бурно реагируют с водой с выделением кислорода.
Присоединяя два электрона, молекула О2 превращается в пероксид-ион О22-, в котором атомы связаны одной двухэлектронной связью, и поэтому он диамагнитен:

Это также согласуется с отсутствием окраски у пероксидов,
Пероксиды образуются при окислении ряда металлов, например:
Ва + О2 = ВаО2
Наибольшее практическое значение имеет пероксид (перекись) водорода Н2О2. Строение молекулы показано ниже:
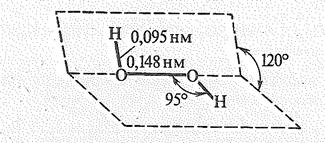
Энергия связи О — О (210 кДж/моль) почти в два раза меньше энергии связи О — Н (468 кДж/моль).
Из-за несимметричного распределения связей Н – О молекула Н2О2 сильно полярна (= 0,7. 10-29 Кл×м). Между молекулами Н2О2 возникает довольно прочная водородная связь, приводящая к их ассоциации. Поэтому в обычных условиях пероксид водорода — сиропообразная жидкость (пл. 1,44) с довольно высокой температурой кипения (т. кип. 150,2 °С, т. пл. 0,41 °С). Она имеет бледно-голубую окраску. Пероксид водорода — хороший. ионизирующий растворитель. С водой смешивается в любых отношениях благодаря возникновению новых водородных связей. Из растворов выделяется в виде неустойчивого кристаллогидрата Н2О2×2Н2О (т. пл. —52,0 °С). В лаборатории обычно используются 3%-ные и 30%-ные растворы Н2О2 (последний называют пергидролем).
В водных растворах пероксид водорода — слабая кислота (Киониз = 2,24×10-12):

В химических реакциях пероксид-радикал может, не изменяясь, переходить в другие соединения, например:
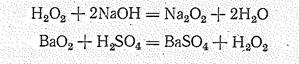
Последняя реакция используется для получения перекиси водорода.
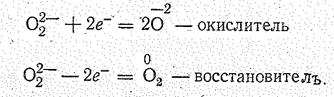 Чаще, однако, протекают реакции, сопровождающиеся разрушением связи О — О или изменением заряда иона О22-. Можно считать, что ион О присоединяет или теряет электроны:
Чаще, однако, протекают реакции, сопровождающиеся разрушением связи О — О или изменением заряда иона О22-. Можно считать, что ион О присоединяет или теряет электроны:
Окислительные свойства пероксидов выражены сильнее, чем восстановительные:

Так, при действии концентрированных растворов Н2О2 на бумагу, опилки или другие горючие вещества происходит их самовоспламенение. Восстановительные свойства перекись водорода проявляет только по отношению к таким сильным окислителям, как ионы МnО4-.
Для пероксида водорода характерен также распад по типу диспропорционирования:
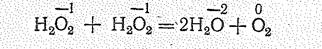
Этот распад ускоряется в присутствии примесей, при освещении, нагревании и может протекать со взрывом. Довольно устойчивы только очень чистая Н2О2 и ее 30—65%-ные растворы. Пероксид водорода и его растворы обычно хранят в темной посуде и на холоде; для стабилизации добавляют ингибиторы.
Водные растворы пероксида водорода широко используются для отбелки различных материалов, для обеззараживания сточных вод. Пероксид водорода применяют как окислитель ракетного топлива.
В последнее время удалось синтезировать Н2О3 и Н2О4. Эти соединения весьма неустойчивы. При обычных температурах они разлагаются за доли секунды. Однако при низких температурах порядка —70°С они существуют часами. Спектроскопическое исследование показывает, что их молекулы имеют зигзагообразную цепную структуру:

Молекулы Н2О2, как и Н2О, могут выступать в качестве нейтральных лигандов, например [Fе(ОН2)5(О2Н2)]3+, и давать аналогичные кристаллогидратам пероксогидраты: К2СО3 ×3Н2O2, СаО2×2Н2O2, ВаO2×2Н2О×2Н2О2 и др. Роль лиганда может играть и пероксидион, например в комплексе [V(О2)4]3-:
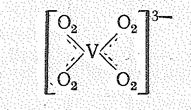
Кислоты, в которых имеется группировка О22-, называют пероксокислотами:

При гидролизе пероксокислот образуется пероксид водорода, что используется для его получения в промышленности.
Характерным свойством пероксидных соединений, как простых, так и комплексных, является способность образовывать пероксид водорода при взаимодействии с разбавленными растворами кислот, а также выделять кислород при термическом разложении или действии воды и других химических агентов. Другие неорганические соединения, которые могут быть источником кислорода, как, например, нитраты, хлораты, перхлораты, перманганаты и некоторые оксиды, не выделяют пероксид водорода при действии воды. Кислород они выделяют только при нагревании и в присутствии катализаторов.
Соединения кислорода (II) и кислорода (I). Можно считать, что электроположительная поляризация атомов кислорода проявляется в соединениях с фтором, а также в ионе О2+. Некоторые примеры фторопроизводных кислородных соединений приведены в табл. 2.
Простейший представитель такого рода соединений — дифторид кислорода ОF2: его получают при быстром пропускании фтора через 2%-ный раствор щелочи:
2F2 + 2NaOH = OF2 + 2NaF + H2O
Таблица 2.
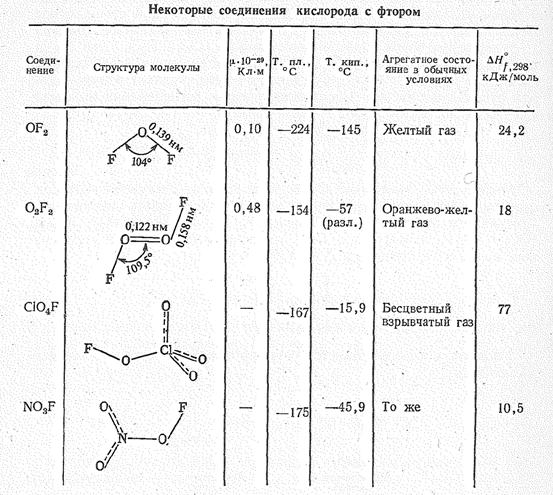
Молекула ОF2 имеет угловую форму (d OF = 0,139 нм, ÐFОF = 104° 16’, m= 0,1 × 10-29 Кл×м.) Дифторид кислорода ядовитый газ бледно-желтого цвета, термически устойчив до 200—250 °С, сильный окислитель, эффективный фторирующий агент.
В диоксидифториде О2F2 радикал О22+ ковалентно связан с атомами фтора. Молекула О2F2 диамагнитна. Это соединение образуется (в виде красной летучей жидкости) в результате непосредственного взаимодействия простых веществ в электрическом разряде или под действием ионизирующих излучений при температуре жидкого воздуха (—190 °С). Согласно спектроскопическим данным молекула О2F2 (m = 0,48×10-29 Кл×м) по структуре аналогична Н2О2:
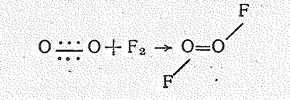
Соединение крайне неустойчиво, что определяется низкой энергией разрыва связи ОF (75 кДж/моль).
Получены также полиоксидифториды типа О4F2, О5F2 и О6F2, существующие лишь при низкой температуре (—190 °с). Предполагают, что их молекулы имеют цепное строение, например F—О—О—О—О—F. Термическая устойчивость полиоксидифторидов уменьшается с увеличением числа атомов в молекуле ОnF2 (n = 2 – 6).
Энергия ионизации молекулы О2 довольно значительная (12,08 эВ), однако при взаимодействии О2 с сильнейшим окислителем РtF6 образуется солеподобное вещество О2+[РF6]-

в котором роль катиона играет молекулярный ион О2+ (диоксигенил):

Гексафтороплатинат (V) диоксигенила О2[РtF6] – парамагнитное вещество красного цвета, плавится с разложением при 219 °С. Синтез этого соединения канадским ученым Н. Бартлетом в 1962 г. послужил толчком к синтезу соединений ксенона, энергия ионизации которого близка к таковой молекулы кислорода.
Производные О2+ получены также при взаимодействии O2F2 и O4F2 с резко кислотными фторидами типа ВF3, РF5, AsF5, SbF5, ВrF5:
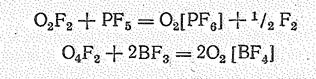
Синтез диоксигенильных солей можно осуществлять нагреванием в автоклаве (в течение 10—20 ч) при 150—500 °С смеси кислорода, фтора и порошка соответствующего металла:
О2 + 3 F2 + Э = O2[ЭF6]
где Э – As, Sb, Bi, Nb, Au, Ru, Rh.
Частота валентных колебаний О2+ в диоксигенильных соединениях близка к таковой для свободного иона, что подтверждает существование иона О2+ в указанных солях. Межъядерное расстояние в катионе О2+, известное из спектроскопических данных (0,112 нм), как и следовало ожидать, короче, чем в О2 0,1207 нм). Ион О2+ имеет один непарный электрон (см. табл. 1). Энергия диссоциации О2F2, ОF2 (~70 кДж/моль) меньше, чем у F2 (159 кДж/моль). Они — удобная форма хранения фтора, который выделяется при распаде этих фторидов уже при обычных температурах.
В соединениях типа СlО4F, NO3F мостиковый атом кислорода относительно центрального атома (Сl, N) поляризован отрицательно, а относительно атома фтора - положительно. Рассматриваемые соединения можно получить при взаимодействии с фтором концентрированных растворов НСlО4 и НNO3 или твердых солей КСlО4 и KNO3
HClO4 + F2 = ClO4F + HF
KNO3 + F2 = NO3F + KF
В воде эти соединения разлагаются, выделяя кислород:
ClO4F + 2Н2О = HClO4 + O2 + 2HF
Производные положительной степени окисления кислорода являются сильнейшими энергоемкими окислителями, способными выделять запасенную в них химическую энергию в определенных условиях. Их можно использовать как эффективные окислители ракетного топлива.
Соединения кислорода (IV). В качестве производного, в котором кислород проявляет степень окисления +4, можно рассматривать аллотропическую модификацию кислорода озон O3 – (О+4O2).
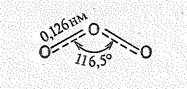
Молекула O3 диамагнитна, имеет угловую форму (ÐООО = 116,5°) и обладает некоторой полярностью (m = 0,17 × 10-29 Кл × м). Длина связи d OO (0,128 нм) является промежуточной между длиной одинарной (0,149 нм) и двойной связи (0,1207 нм). Поэтому считают, что в молекуле О3 порядок связи 1,5. Строение молекулы О3 можно передать следующей структурной формулой:
Исходя из приведенных данных, строение молекулы О3 можно объяснить следующим образом. Центральный атом кислорода молекулы О3 находится в состоянии sр 2-гибридизации (за счет 2 s -, 2 p х н 2 р y,-орбиталей). Две из гибридных sр 2-орбиталей центрального атома участвуют в образовании двух s-связей О—О (двух молекулярных sсв.-орбиталей). Третья sр 2-гибридная орбиталь (молекулярная s-орбиталь) содержит неподеленную электронную пару. 2 р z -орбиталъ центрального атома (расположенная перпендикулярно плоскости расположения атомов) и 2 р z-орбитали крайних атомов участвуют в образовании нелокализованной p-связи (молекулярная pсв.-орбиталь). Таким образом, невозбужденное состояние молекулы О3 отвечает следующему заполнению молекулярных орбиталей: (sсв.)4(pсв.)2(s)2.
Остальные электроны заполняют несвязывающие орбитали, локализованные у периферических атомов.
Шести электронам, связывающим три атома кислорода, соответствует порядок связи 1,5.
Озон газ синего цвета с резким раздражающим запахом, очень токсичен. Жидкий озон — темно-синяя жидкость, твердый – темно- фиолетовые кристаллы (т. пл. —192,7 °С). Поскольку молекула О3 обладает большей полярностью и поляризуемостью, озон имеет более высокую температуру кипения (—111,9 °С), чем кислород. Этим же объясняется большая интенсивность окраски озона и лучшая его растворимость в воде.
Озон образуется в процессах, сопровождающихся выделением атомарного кислорода (радиолиз воды, разложение перекисей и др.), а также при действии на молекулярный кислород потока электронов, протонов, коротковолнового излучения, т. е. за счет радиохимических
и фотохимических реакций. Цепную реакцию образования озона из кислорода можно представить схемой
О2 + h n ® O2·
O2· + O2 = O3 + ·O·
·O· + O2 = O3
или суммарно 3О2 = 2О3 DGо298 = 326 кДж/моль.
В естественных условиях озон образуется из атмосферного кислорода при грозовых разрядах, а на высоте 10—30 км — под действием ультрафиолетовых солнечных лучей. Озон задерживает вредное для жизни ультрафиолетовое излучение Солнца и поглощает инфракрасное излучение Земли, препятствуя ее охлаждению. Следовательно, «озонный пояс» играет большую роль в обеспечении жизни на Земле.
В технике озон получают в озонаторах действием тихого электрического разряда на кислород.
Озон — вещество эндотермическое (DНof,298 = 142,3 кДж/моль, DGof,298 = 162,7 кДж/моль). Но тем не менее в отсутствие катализаторов или без ультрафиолетового облучения газообразный озон разлагается довольно медленно даже при 250 °С. Жидкий озон и его концентрированные смеси (70% 0) взрывчаты.
Окислительная активность озона заметно выше, чем О2. Например, уже при обычных условиях он окисляет многие малоактивные простые вещества (Аg, Нg и пр.):
8Аg + 2O3 = 4Аg2О + O2
О более высокой химической активности О3, чем O2, свидетельствует также сравнение их окислительно-восстановительных потенциалов для водных растворов, например:
О3 (г) + Н2О (ж) + 2е- = О2 (г) + 2ОН- (р), Ео298 = 1,24 В;
О2 (г) + 2Н2О (ж) + 4е- = 4ОН- (р), Ео298 = 0,401 В.
Для количественного определения озона можно использовать его взаимодействие с раствором КI:
2I- (р) + O3 (г) + Н2O (ж) = I2 (т) + 2ОН- (р) + О2 (г)
Сродство к электрону озона около 180 кДж/моль, поэтому он может переходить в озонид -ион О3-. В частности, при действии озона на щелочные металлы образуются озониды: К + О3 = КО3
Озониды — это соединения состоящие из положительных ионов металла и отрицательных ионов О3- (d OO = 0,134 нм). Наличие в ионе О3- непарного электрона обусловливает парамагнетизм и наличие окраски у озонидов, Обычно они окрашены в красный цвет.
Как сильный окислитель озон используется для очистки питьевой воды, для дезинфекции воздуха, в различных химических синтезах.
[1] Тремя точками обозначены связи, обусловленные двумя pсв. и одним pразр. электроном, что отвечает порядку связи 0,5. Во второй формуле непарные точки означают pразр.-электроны, При возбуждении молекул О2 становится диамагнитной. Этому состоянию отвечает структурная формула.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 6730; Нарушение авторских прав?; Мы поможем в написании вашей работы!