
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
As2S3— аурипигмент, Аs4S4 — реальгар, Sb2S3 — сурьмяный блеск (антимонит), Вi2S3 — висмутовый блеск (висмутин), а также FеАsS — мышьяковый колчедан (арсенопирит)
|
|
|
|
Т 4 Л 10 Подгруппа мышьяка
Мышьяк Аs, сурьма Sb и висмут Вi — полные электронные аналоги с конфигурацией s 2 р 3. По мере увеличения размеров атомов в ряду Аs — Sb — Вi значения устойчивых координационных чисел возрастают. Степени окисления мышьяка, сурьмы и висмута равны —3, +3 и +5. Вследствие особой устойчивости конфигурации 6 s 2 для висмута наиболее характерна степень окисления +3.
Содержание в земной коре мышьяка, сурьмы и висмута сравнительно невелико. Они обычно встречаются в виде сульфидных минералов:
Простые вещества. В ряду N—Р—Аs—Sb—Вi отчетливо наблюдается усиление металлических признаков простых веществ.
В частности, в этом ряду устойчивость неметаллических модификаций падает, а металлических возрастает. Мышьяк, как и фосфор, имеет несколько аллотропных форм. При быстром охлаждении пара (состоящего из молекул As4) образуется неметаллическая модификация — желтый мышьяк (пл. 2,0 г/см3), изоморфный белому фосфору и подобно ему растворимый в сероуглероде. Эта модификация менее устойчива, чем белый фосфор, и при действии света или при слабом нагревании легко переходит в металлическую модификацию — серый мышьяк. Неметаллическая модификация сурьмы (желтая сурьма) еще менее устойчива, чем желтый мышьяк. У висмута же неметаллическая модификация неизвестна вообще.
Устойчивые в обычных условиях модификации — серый мышьяк, серая сурьма и висмут — имеют металлический вид, электропроводны, но хрупки. Они изоморфны, имеют слоистую структуру типа черного фосфора. Каждый из атомов пирамидально связан с тремя соседними по слою и имеет трех ближайших соседей в другом слое. В ряду As—Sb—Вi различие межъядерных расстояний внутри и между слоями уменьшается (0,063—0,050—0,0З7 нм), т. е. происходит постепенно приближение к характерному для металлических структур равенству межъядерных расстояний. Благодаря близости параметров кристаллических решеток сурьма образует твердые растворы с мышьяком и висмутом, но последние друг с другом их не образуют.
Некоторые сведения о простых веществах р -элементов V группы приведены ниже: (в твердом состоянии; При 1,8×109 Па; При 3,6×106 Па.)

В обычных условиях металлические модификации устойчивы по отношению к воздуху и воде. В ряду напряжений они располагаются после водорода. При взаимодействии с концентрированной НNО3 мышьяк переходит в мышьяковую кислоту:
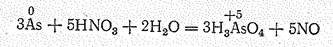
Сурьма в этих же условиях образует b-сурьмяную кислоту НSbO3 (Sb2О5× nН2О):
3Sbo + 5HNO3 = 3НSb+5O3 + 5NO + Н2О
Висмут же в концентрированной НNО3 пассивируется, а с разбавленной дает нитрат, т. е. ведет себя как металл:
Вio + 4HNO3 = Вi+3(NO3)3 + NО + 2Н2О
Для получения мышьяка, сурьмы и висмута их природные сульфиды обжигают; образующиеся при этом оксиды восстанавливают углем:
2Э2S3 + 9O2 = 6SO2 + 2Э2O3
Э2O3 + 3С = 2Э + 3СО
Мышьяк, сурьма и висмут существенно отличаются по структуре от типичных металлов и поэтому с металлами твердые растворы обычно не образуют. Более характерно возникновение эвтектических смесей. Так, сплав состава 60% Вi и 40% Сd плавится при 144 °С. Широко применяемый сплав Вуда, температура плавления которого 65 – 70 °С, т. е. ниже точки кипения воды, содержит 50 % Вi, 25 % Рb, 12,5 % Sn и 12,5 % Сd. Сплав состава 41 % Вi, 22 % Рb, 11 % Sn, 8 % Сd и I8 % In плавится лишь при 47 °С. Сплавы висмута эвтектического состава применяются в автоматических огнетушителях и в качестве припоев.
Мышьяк и сурьма используются главным образом в качестве добавки к свинцу для придания ему повышенной твердости. Важное значение имеет типографский сплав, содержащий 25 % Sb, 60% Рb и 15% Sn.
Соединения со степенью окисления мышьяка, сурьмы и висмута—3. В качестве солеподобных соединений, в которых мышьяк, сурьма и висмут проявляют степень окисления —3, можно рассматривать арсениды, стибиды (антимониды) и висмутиды s -элементов I и II групп (К3Э, Са3Э2, Мg3Э2 и др.). В большинстве же других случаев при взаимодействии металлов с мышьяком, сурьмой и висмутом образуются соединения металлического типа. Стибиды и арсениды р -элементов и элементов подгруппы цинка — полупроводники. В ряду однотипных нитридов, фосфидов, арсенидов, стибидов и висмутидов ширина запрещенной зоны уменьшается, что свидетельствует об увеличении доли нелокализованной связи. Например:
АlN АlР АlAs АlSb
DЕ, эВ ……………3,8 3,0 2,16 1,6
Большинство арсенидов, стибидов и висмутидов довольно легко разлагается кислотами.
Ослабление признаков неметаллических элементов в ряду Аs—Sb—Вi проявляется также в их соединениях с водородом Н3Э. Строение молекул Н3Э аналогично строению Н3N и H3Р. Но по мере увеличения размеров электронных облаков в ряду N—Р—As—Sb—Вi полярность и прочность связи Э — Н уменьшается. По этой же причине несвязывающее двухэлектронное облако становится пространственно менее направленным, значение валентного угла - ÐНЭН приближается к 90о и наблюдается уменьшение электрического момента диполя молекул. В обычных условиях Н3Аs (арсин), Н3Sb (стибин) и ВiН3 (висмутин) — газообразные вещества с резким запахом. Арсин, стибин и особенно висмутин сильно эндотермичны. При нагревании они довольно легко распадаются с образованием на стенках сосуда черного осадка с металлическим блеском (простые вещества Аs, Sb, Вi). В ряду Н3Аs—Н3Sb—ВiН3 устойчивость падает, вследствие чего висмутин недостаточно изучен. Все они сильные восстановители.
Образуются Н3Э действием разбавленных кислот на арсениды, стибиды и висмутиды:
Мg3Э2 + 6НСl = 3МgСl2 + 2Н3Э
а также действием цинка на подкисленные растворы соединений:
Аs2O3 + 6Zn + I2НСl = 2Н3Аs + 6ZnСl2 + 3Н2O
Арсин (в меньшей степени стибин и висмутин) очень токсичен. Поскольку цинк почти всегда содержит небольшие количества мышьяка, опасно вдыхать водород, выделяющийся при действии кислот на цинк.
В ряду Н3N—Н3Р—Н3Аs—Н3Sb—ВiН3 электронодонорные свойства молекул ослабевают. Так, если производные аммония вполне устойчивы, то арсоний -ион АsН5+ обнаружен лишь с помощью ИК-спектра (в смеси Н3Аs и НI при низкой температуре). Ионы SbH4+ и ВiН4+ вообще не обнаружены.
В молекулах арсина и стибина связь почти неполярна и в зависимости от условий характер поляризации атомов Аs и Sb может изменяться. Поэтому для Н3Аs и Н3Sb характерен ряд свойств гидридов, т. е. производных Аs (III) и Sb (III). В частности, при взаимодействии арсина с растворами щелочей выделяется водород.
Соединении мышьяка (III), сурьмы (III) и висмута (III). В степени окисления +3 атомы Аs, Sb и Вi сохраняют несвязывающую электронную пару; имеют координационные числа 3, 4, 5 и 6. Этим координационным числам отвечают структурные единицы в виде тригональной пирамиды искаженного тетраэдра, тетрагональной пирамиды, искаженного октаэдра соответственно.
Степень окисления +3 у мышьяка и его аналогов проявляется в галогенидах ЭНаl3, оксидах Э2О3, сульфидах Э2S3. Бинарные соединения и гидроксиды Э(III) амфотерны.
В ряду однотипных соединений Аs (III) — Sb (III) — Вi (III) кислотные признаки ослабевают и нарастают основные.
Оксиды Э2О3 получают прямым взаимодействием простых веществ, Sb2О3 также окислением сурьмы разбавленной НNО3, а Вi2О3 — термическим разложением Вi(NO3)3.
Структура оксидов в при переходе от Аs (III) к Вi (III) существенно изменяется. Кристаллы низкотемпературных модификаций Аs2О3 и Sb2O3 имеют, как и Р2O3, молекулярную решетку, построенную из молекул Э4O6. Последние состоят из четырех объединенных друг с другом пирамид ЭO3. В высокотемпературной модификации Sb2O3 пирамиды SbO3 связаны в бесконечные сдвоенные цепи:
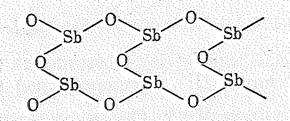
Оксид висмута (III) Вi2O3 имеет координационную решетку с искаженной октаэдро-тетраэдрической координацией атомов. Различие в структуре, естественно, сказывается на свойствах оксидов.
Аs2O3 (белый мышьяк) — преимущественно кислотный оксид. Он растворяется в воде и щелочах, но в отличие от Р2О3 взаимодействует также с галогеноводородными кислотами:
Аs2O3 + Н2О = 2Н3АsO3
Аs2O3 + 8НCl = 2HAsCl4 + H2O
Sb2O3 в воде практически не растворяется, но взаимодействует со щелочами, а также с соляной кислотой.
Взаимодействие Аs2O3 с растворами щелочей приводит к образованию соответственно гидроксоарсенатов (III) (гидроксоарсенитов) и гидроксостибатов (III) (гидроксоантимонитов):
Э2О3 + 2КОН +3Н2О = 2К[Э(ОН)4]
Наоборот, Вi2О3 легко взаимодействует с кислотами, образуя разнообразные соли Вi (III), в воде не растворяется, со щелочами практически не реагирует.
Аналогично изменяются свойства и в ряду гидроксидов. В отличие от Н3РО3 гидроксиды Аs(ОН)3 и Sb(ОН)3 амфотерны: у первого преобладают кислотные свойства, у второго — основные. При этом и кислотная, и основная ионизации Э(ОН)3 в растворе выражены слабо.
В свободном состоянии Аs(ОН)3 не выделен, в водном растворе ведет себя как слабая кислота Н3АsО3, называемая мышьяковистой.
Гидроксиды Sb (III) и Вi (III) в воде практически не растворяются. Они получаются в виде белых осадков переменного состава Э2O3×nН2О при действии щелочей на катионные производные Э (III):
Bi(NO3)3 + 3KOH = Bi(OH)3¯ + 3KNO3
или кислот на анионные производные Э (III):
Nа[Sb(ОН)4] + НСl = NаСI + Sb(ОН)3¯ + Н2О
При сплавлении Э2O3 или Э(ОН)3 со щелочами обычно образуются полимерные метаарсенаты (III) (метаарсениты) и метастибаты (III) (метаантимониты) состава М+1ЭО2.
Оксовисмутаты (III) неустойчивы.
Ослабление кислотных признаков проявляется также в ряду сульфидов Э2S3. Желтый Аs2S3, оранжевый Sb2S3 и черно-бурый Вi2S3 твердые вещества, нерастворимые в воде.
Сульфиды образуются непосредственным взаимодействием простых веществ или действием сероводорода на растворимые соединения Э (III) в кислой среде:
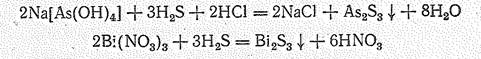
Сульфиды Аs (III) и Sb (III) — преимущественно кислотные соединения. Они легко растворяются в присутствии основных сульфидов с образованием сульфидоарсенатов (III) и сульфидостибатов (III) типа М+1ЭS2 и М+13ЭS3:
Э2S3 + (NH4)2S = 2NH4ЭS2
Растворяются As2S3 и Sb2S3 и в щелочах.
Сульфид висмута (III) Вi2S3 кислотные свойства в растворах не проявляет, с основными сульфидами взаимодействует лишь при сплавлении.
Соединения Э2S3 характеризуются сравнительно небольшими значениями энергий Гиббса образования; довольно легко переходят в Э2О3, ЭF3 и ЭСl3 при окислении кислородом, фтором и хлором, например:
2Sb2S3 + 9O2 = 2Sb2O3 + 6SO2
В отличие от Аs2S3 сульфиды Sb (III) и Вi (III) растворяются в концентрированной соляной кислоте:
Sb2S3 + 8НСI «2НSbСl4 + 3Н2S
Тригалогениды элементов подгруппы мышьяка ЭНаl3 получают взаимодействием простых веществ при недостатке галогена. У большинства тригалидов элементов подгруппы мышьяка кристаллические решетки молекулярны. Температура плавления трифторида висмута, имеющего координационную решетку, наиболее высокая (730 °С).
Подобно Э2О3 и Э2S3, галогениды Аs (III) — кислотные соединения, галогениды Sb (III) и Вi (III) проявляют также свойства солей.
При гидролизе АsНаl3 образуются кислоты. Однако в отличие от РНаl3 гидролиз АsНаl3 обратим:
АsСl3 + 4Н2O = Н[Аs(ОН)4] + 3НСl
Гидролитическое разложение галогенидов Sb (III) и Вi (III) также преобладает над их электролитической диссоциацией. Гидролиз протекает энергично до оксогалогенидов, например:
SbСl3 + Н2O «SbОСl + 2НСl
Оксогалогениды Sb (III) и Вi (III) состава ЭОНаl в обычных условиях – твердые, нерастворимые в воде вещества с координационнослоистой решеткой, структурно совершенно отличные от аналогичных соединений фосфора (III) и мышьяка (III).
Ослабление неметаллических свойств в ряду Аs – Sb – Вi проявляется также в изменении устойчивости солей и солеподобных соединений Э (III). Последние для Аs (III) неустойчивы и в свободном состоянии не выделены, а для Sb (III) известны сульфат Sb2(SO4)3, нитрат Sb(NО3)3 и некоторые другие. В воде эти соединения энергично разлагаются. Относительно устойчивы комплексные стибаты (III) s -элементов I группы, например сульфатостибаты (III) М+1[Sb(SO4)2].
Соли Вi (I1I) весьма разнообразны и устойчивы. Кислотные признаки у них проявляются в характере гидролиза (который у них преобладает над электролитической диссоциацией)
Вi(NО3)3 + Н2O «ВiОNО3 + 2НNO3
и в способности образовывать производные типа M+1[Вi(SО4)2], М+1[Вi(NО3)4].
Соединения Аs (IП) довольно легко окисляются. Так, Аs2S3 окисляется персульфидом аммония:
Аs2S3 + 2(NН4)2S2 = 2NН4ЭS2
а Аs2О3 – азотной кислотой:
Аs2O3 + 4HNO3 +7H2O = 6H3AsO4 + 4NO
У производных Sb (III) восстановительная активность проявляется в меньшей степени, однако Sb2S3 также окисляется персульфидом аммония. Окисление же соединений Вi (ПI) возможно лишь наиболее сильными окислителями в сильнощелочной среде, например:
ВiСl3 + Сl2 + 6КОН = КВiО3 + 5КСl + 3Н2O
Соединения мышьяка (V), сурьмы (V) и висмута (V). В ряду Аs (V) – Sb (V) – Вi (V) устойчивость соединений в целом падает. При рассмотрении подгрупп брома и селена было показано, что высшая степень окисления в этих подгруппах наиболее характерна для р -элементов 5-го периода, т. е. для I и Те. Наименее устойчива высшая степень окисления для р -элементов 6-го периода, т. е. для Аt и Ро. Подобная закономерность, хотя и выраженная - менее отчетливо, проявляется и в подгруппе мышьяка; степень окисления +5 наиболее характерна для Sb, менее характерна для Аs и неустойчива у Вi.
Для висмута (V) получен лишь фторид ВiF5, для мышьяка (V) и сурьмы (V), кроме того, известны оксиды Э2О5, сульфиды Э2S5, а для сурьмы (V) — еще и хлорид SbСl5:
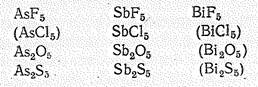
По химической природе бинарные соединения мышьяка (V) и его аналогов кислотные. Им соответствуют анионные комплексы, простейшие из которых ЭНаl6-, ЭО43-, Э(ОН)6-.
Оксиды Э2O5 в обычных условиях твердые вещества. По структуре и свойствам Аs2O5 напоминает Р2O5, довольно хорошо растворяется в воде:
Аs2O5 + 3Н2O = 2Н3АsО4
Sb2O5 (желтого цвета) в воде растворим мало, лучше в щелочных растворах:
Sb2O5 + 2КОН + 5Н2О = 2К[Sb (ОН)6]
Оксоарсенаты (V) и оксостибаты (V), образующиеся при сплавлении Аs2O5 и Sb2О5 со щелочами и оксидами металлов, в большинстве полимерны.
Структура оксоарсенатов обычно подобна структуре оксофосфатов (V).
Чаще всего полимерные висмутаты отвечают составу М+1ВiО3.
Из растворов обычно выделяются тетраоксоарсенаты типа М+13АsО4 и гексагидроксостибаты типа М+1[Sb(ОН)6]. Подобно фосфатам арсенаты, стибаты и висмутаты, как правило, трудно растворимы в воде.
Из соответствующих соединений водорода в свободном состоянии получен лишь оксоарсенат (V) водорода Н3АsО4 (мышьяковая кислота) — твердое, растворимое в воде вещество, Н3АsО4 получают окислением Аs или Аs2О3 азотной кислотой. Мышьяковая кислота (К1 = 6×10-3) слабее фосфорной. При попытке получения сурьмяных кислот образуется осадок неопределенного состава Sb2O5×nН2О. Не выделены в свободном состоянии и висмутовые кислоты.
Сульфиды Э2S5 во многом напоминают оксиды Э2O3. Желтый Аs2S5 и оранжевый Sb2S5 с водой не взаимодействуют; будучи кислотными соединениями, они растворяются в присутствии основных сульфидов и при действии щелочей:
Э2S5 + 3Nа2S = 2Nа3ЭS4
Сульфиды Э2S5 можно получить либо взаимодействием простых веществ, либо осаждением при действии Н2S на производные Э(V) в кислой среде:
2Nа3АsО4 (р) + 5Н2S (р) + 6НСl (р) = Аs2S5 (т) + 6NаС1 (р) + 8Н2O (ж)
Соответствующие сульфидоарсенаты (V) и сульфидостибаты (V) (тиоанатимонаты) водорода в свободном состоянии неустойчивы.
Молекулы пентагалогенидов ЭНаl5, как и РНаl5, имеют форму тригональной бипирамиды.
В обычных условиях АsF5 — газ (Тпл. —80 °С, Ткип. —53 °С), а SbF5 (Тпл. 8 °С, Ткип. 142 °С) и SbСl (Тпл. 30 oС, Ткип. 140 оС) – жидкости; ВiF5 — твердое вещество (Тпл. 151 oС, Ткип. 230 °С). Резкое повышение точек плавления и кипения при переходе от АsF5 и SbF5 обусловливается ассоциацией молекул SbF5 в полимерные цепи, образованные октаэдрическими структурными единицами SbF6 (—SbF4 — F — SbF4 — F —). Пентагалиды типичные кислотные соединения. При взаимодействии с водой ЭНаl5 дают кислоты, с основными галогенидами образуют галогеноарсенаты (V) и галогеностибаты (V):
КF + ЭF5 = К[ЭF6]
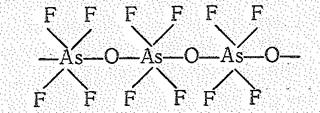
Пентафториды ЭF5—очень сильные акцепторы фторид-иона; при взаимодействии с ЭF5 основные свойства проявляют даже такие соединения, как НF, O2F2, N2F4, СlF5.
Производные типа М[ЭOF4] образованы полимерными анионами в виде цепи октаэдрических структурных единиц:
Соединения висмута (V) сильные окислители. Они, например, переводят Мn (II) в Мn (VII):
2Мn2 + 5ВiО3- + 14Н+ = 5Вi3+ + 2МnО4- + 7Н2O
Производные сурьмы (V) окислительные свойства проявляют в меньшей степени, однако Sb2O5 может окислять концентрированную соляную кислоту по обратимой реакции:
Sb2O5 + I0НСl «2SbСl3 + 2Сl2 + 5Н2O
Применение соединений мышьяка, сурьмы и висмута весьма разнообразно. Так, производные Аs в сельском хозяйстве служат одним из основных средств борьбы с вредителями культурных растений. Например, Nа3АsО4, Са3(АsО4)2, Са(AsO2)2, и другие применяются как инсектициды. Важное применение соединения мышьяка (Аs2O3, КАsО2, органические производные) находят в медицине. Лекарства на их основе рекомендуют при малокровии, истощении, используют в стоматологической практике. Производные Аs, Sb и Bi нашли применение также в производстве керамики и в других областях.
Соединения сурьмы, висмута и в особенности мышьяка ядовиты.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1755; Нарушение авторских прав?; Мы поможем в написании вашей работы!