
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Алюминий
|
|
|
|
 Атом алюминия (1s22s22р63s23р1) больше по размеру, чем атом бора, и обладает меньшей энергией ионизации. Следовательно, неметаллические признаки химического элемента алюминия выражены в меньшей степени, чем химического элемента бора. Для алюминия, как и для бора, наиболее характерна степень окисления +3. Отрицательная поляризация атомов алюминия проявляется еще реже. Для алюминия (III) наиболее характерны к оординационные ч исла 6 и 4.
Атом алюминия (1s22s22р63s23р1) больше по размеру, чем атом бора, и обладает меньшей энергией ионизации. Следовательно, неметаллические признаки химического элемента алюминия выражены в меньшей степени, чем химического элемента бора. Для алюминия, как и для бора, наиболее характерна степень окисления +3. Отрицательная поляризация атомов алюминия проявляется еще реже. Для алюминия (III) наиболее характерны к оординационные ч исла 6 и 4.
Алюминий — типичный амфотерный элемент, в отличие от бора для него типичны не только анионные, но и катионные комплексы.
По распространенности на Земле (6,6 мол. доли, %) алюминий занимает четвертое место (после О, Н, Si), состоит из одного стабильного изотопа 27А1. Основная масса алюминия сосредоточена в алюмосиликатах. Из других минералов наибольшее промышленное значение имеют боксит Аl2О3×nН2О и криолит Nа3АlF6. Распространенным продуктом разрушения горных пород является каолин, состоящий в основном из глинистого минерала каолинита Аl4[Si4О10](ОН)8 (Аl2О3 ×SiО2×2Н2О).
Простое вещество. В виде простого вещества алюминий — серебристо-белый металл (Tпл. 660 °С, Tкип. 2500 °С). Кристаллизуется в гранецентрированной кубической решетке. Обладает высокой электрической проводимостью и теплопроводностью, исключительно пластичен.
Алюминий химически активен; даже в обычных условиях покрывается очень прочной тончайшей (0,00001 мм) оксидной пленкой. Последняя несколько ослабляет металлический блеск алюминия и определяет его довольно высокую коррозионную стойкость. Так, алюминий горит в кислороде лишь при высокой температуре и притом в мелкораздробленном состоянии. Взаимодействие сопровождается большим выделением тепла (DНof = —1650 кДж/моль Аl2О3). Подобным же образом протекает взаимодействие алюминия с серой. С хлором и бромом он реагирует при обычной температуре, а с иодом при нагревании или в присутствии воды как катализатора. При сильном нагревании реагирует с азотом (800 °С) и углеродом (2000 °С). С водородом непосредственно не взаимодействует.
Вследствие высокого сродства к кислороду (DGo298 = —1582 кДж/моль Аl2O3) алюминий активно восстанавливает многие металлы из оксидов (а люмотермия [1] ). При этом реакция обычно сопровождается выделением
большого количества тепла и повышением температуры до 1200 — 3000 оС. Алюмотермия применяется в производстве марганца, хрома, ванадия, вольфрама, ферросплавов,
О высокой химической (восстановительной) активности алюминия свидетельствуют также значения его стандартного электродного потенциала в кислой и щелочной среде:

Будучи амфотерным, алюминий растворяется в растворах кислот и щелочей, образуя соответственно катионные и анионные комплексы:

Как в том, так и в другом случае окисление алюминия сопровождается выделением водорода. Если механическим путем или амальгамированием снять предохраняющее действие оксидной пленки, то алюминий энергично взаимодействует с водой:
2Al + 6H2O = 2Al(OН)3 + 3Н2
Вследствие образования защитной пленки алюминий устойчив в очень разбавленной НNO3 и концентрированных растворах Н NO3 и Н2SO4 на холоду. Склонность к пассивированию позволяет повысить коррозионную стойкость алюминия обработкой его поверхности соответствующими окислителями (конц. НNO3, К2Сr2O7) или анодным окислением. При этом толщина защитной пленки возрастает. Устойчивость алюминия позволяет использовать его для изготовления емкостей для хранения и транспортировки азотной кислоты.
По применению алюминий занимает одно из первых мест среди металлов, Из него изготовляется химическая аппаратура, электрические провода, конденсаторы и др. Алюминиевая фольга (толщиной 0,005 мм) применяется в пищевой и фармацевтической промышленности для упаковки продуктов и препаратов. Основная масса алюминия используется для получения легких сплавов — дюралюмина (94 % Аl, 4 % Сu, по 0,5 % Mg, Мn, Fе и Si), силумина (85—90 % Аl, 10—14 % Si, 0,1 % Nа) и др. Сплавы алюминия широко используются в автомобилестроении, судостроении, авиационной технике и пр. Алюминий применяется, кроме того, как легирующая добавка ко многим сплавам для придания им жаростойкости. Соединения алюминия с d -элементами — алюминиды и их сплавы используются в качестве жаропрочных (до 1200 °С) материалов (NiАl, Ni3Аl, СоAl, Тi3АI, ТiАl и др.).
В промышленности алюминий получают электролизом раствора глинозема Al2О3 в расплавленном криолите Nа3АlF6. Концентрации Nа3АlF6 (92—94 %) и А12O3 в смеси отвечают эвтектическому состоянию. Это позволяет вести процесс электролиза при сравнительно низкой температуре (800—1000 °С). На корпусе электролизера, который служит катодом, выделяется жидкий алюминий. На угольном аноде выделяется кислород, который взаимодействует с углем. Поскольку расплав имеет сравнительно низкую плотность, алюминий погружается на дно электролизера.
Соединения алюминия (III). Бинарные соединения алюминия в обычных условиях полимерны в представляют собой твердые вещества белого цвета.
Оксид алюминия известен в виде нескольких модификаций. Наиболее устойчивой кристаллической формой является a-Аl2O3 (ромбоэдрическая решетка). В его кристаллах проявляется октаэдро-тетраэдрическая координация атомов (к. ч. Al 6, к. ч. О 4). Эта модификация встречается в земной коре в виде минерала корунда, который часто содержит примеси, придающие ему окраску. Прозрачные окрашенные кристаллы корунда — рубин (красный — примесь Сr+3) и сапфир (синий — примесь Тi+4, Fе+2, Fе+3) — драгоценные камни. Их получают также и искусственно.
Высокая прочность связи Аl—О—Al, плотная кристаллическая структура, предопределяют большую энтальпию образования, высокую температуру плавления (порядка 2070 °С), твердость и огнеупорность оксида алюминия. (Это может быть также объяснено донорно-акцепторным взаимодействием свободных d -орбиталей атомов Al и неподеленных электронных пар атомов О.) Так, корунд по твердости уступает лишь алмазу (а также карборунду и эльбору [2]) и применяется в качестве абразивного материала в виде корундовых кругов и наждака. В качестве абразивного и огнеупорного материала широко используется также искусственно получаемый из бокситов сильно прокаленный Аl2О3, называемый алундом. Благодаря высокой твердости искусственно получаемые монокристаллы корунда (в частности, рубины) используют как опорные камни в точных механизмах. В последнее время искусственные рубины используют в качестве квантовых генераторов (лазеры).
Кристаллические модификации Аl2О3 химически очень стойки, не взаимодействуют с водой и кислотами. Щелочами разрушаются лишь при длительном нагревании.
Основная область применения Al2O3 — производство металлического алюминия. Используемый для этих целей глинозем получают из бокситов и комплексной переработкой нефелина (Na3K[AlSiO4]4).
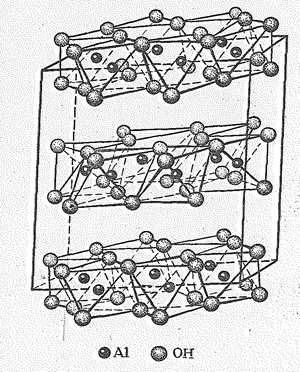
Гидроксид алюминия Аl(ОН)3 — полимерное соединение. Так, природный гидроксид (минерал гидраргиллит) имеет слоистую кристаллическую решетку (рис. 6). Слои состоят из октаэдров Аl(ОН)6; между слоями действует водородная связь. Получаемый по обменной реакции гидроксид – студенистый белый осадок. Состав и структура осадка существенно зависят от условий получения и хранения. Обычно приводимое уравнение реакции получения гидроксида не раскрывает всей сложности механизма его образования.
Аl3+ + 3ОН- = Аl(ОН)3
Получение гидроксида можно представить в виде следующей схемы. При действии щелочей ионами ОН- постепенно замещаются в аквокомплексах [Аl(ОН2)6]3+ молекулы воды:

| 
|
Рис. 6 Структура гидраргиллита
Аl(ОН)3
Одновременно происходит полимеризация с образованием многоядерных комплексов и в конечном итоге — выпадение осадка переменного состава А12О3×nН2О:

При стоянии осадок постепенно (с выделением воды) переходит в кристаллический Аl(ОН)3 и теряет свою активность — «стареет». Кристалллический Аl(ОН)3 получают при пропускании СО2 в щелочной раствор алюмината.
При прокаливании А12О3×nН2О постепенно теряет воду, превращаясь в оксоловые производные и в конечном счете в А12О3. Механизм дегидратации достаточно сложен, и получаемые промежуточные продукты в зависимости от исходного вещества и условий обезвоживания имеют различные свойства. Некоторые из них химически активны (преобладание ОН-мостиков) и легко растворяются в кислотах и щелочах, другие — химически неактивны (ОН-группы замещены на атомы О) и взаимодействуют лишь при сплавлении со щелочами. Одна из форм дегидратированного гидроксида — алюмогель используется в технике, как и силикагель, в качестве адсорбента.
Гидроксид алюминия — типичное амфотерное соединение; свежеполученный продукт легко растворяется и в кислотах, и в щелочах. При этом разрушается высокомолекулярный гидроксид. В зависимости от среды образуются комплексные либо катионы, либо анионы:

Из кислых растворов выделяются кристаллогидраты соответствующих солей алюминия. Например, АlС13×6Н2О, Аl(NO3)3×9Н2O, А12(SO4)3×18Н2O, M+1Аl(SО4)3×12Н2O (квасцы). Соли алюминия и кислородсодержащих кислот растворимы в воде. Нерастворим АlРО4, имеющий координационную структуру типа SiО2.
В растворах соли алюминия гидролизуются. Начальные стадии гидролиза можно описать уравнениями

Вследствие гидролиза сульфид, карбонат, цианид и некоторые другие соли алюминия из водных растворов получить не удается.
Из солей алюминия широкое применение имеют его сульфат и квасцы, используемые в бумажной промышленности для проклейки бумаги писчих сортов, в кожевенной — для дубления кожи, в текстильной при крашении тканей и т. д.
При кристаллизации из щелочных растворов некоторые алюминаты сохраняют состав гидроксосоединений (например, Са3[Аl(ОН)6]2), а другие подвергаются частичной дегидратации (например, К[Аl(ОН)4]).
Сплавляя Аl(ОН)3 или Аl2О3 со щелочами, получают высокомолекулярные метаоксоалюминаты. В воде оксоалюминаты щелочных металлов легко гидролизуются, вплоть до выделения Аl(ОН)3.
Как и в оксиде алюминия, структурной единицей метаоксоалюминатов является октаэдр АlО6. К метаалюминатам можно отнести некоторые смешанные оксиды, например минерал шпинель МgАl2О4 и аналогичные ему по составу и структуре алюминаты типа М+2Аl2О4 или М+2(АlО2)2 (М = Ве, Zn, Fе, Мn).
Способность алюминия давать анионные комплексы определяет нахождение алюминия в природе в виде алюмосиликатов. В них алюминий играет такую же роль, как кремний; оба эти элемента образуют смешанное соединение алюминат-силикат Алюмосиликаты можно рассматривать как силикаты, в которых часть кремнекислородных тетраэдров. SiO4+4 заменена на алюмокислородные тетраэдры АlO5-4. Так, частичное замещение атомов Si на атомы Аl в SiO2 (или Si4O8) дает алюмосиликатные ионы типа [АlSi3O8]-, [Аl2Si2O8]2-. При замене атомов Si в ионах силикатов слоистой структуры Si2O52- (или Si4O104-) атомами А1 образуются слоистые алюмосиликатные ионы, например, типа [АlSi3O10]5-.
Из алюмосиликатов наиболее распространены полевые шпаты. Главные их представители минералы ортоклаз К[А1Si3O10], альбит Na[А1Si3O10] и анортит Са[Аl2Si2O10]. Очень распространены минералы группы слюд, например мусковит КАl2[АlSi3O10](ОН)2, большое практическое значение имеет минерал нефелин (Nа,К)2[А12Si2О8].
Нефелин используется для получения глинозема, содовых продуктов и цемента. Это производство складывается из следующих операций:
а) нефелин и известняк спекают в трубчатых печах при 1200 °С:
(Nа,К)2[А12Si2О8] + 2СаСО3 = 2СаSiО3 + NаАlО2 + КАlО2 + 2СO2
б) образовавшуюся массу выщелачивают водой - образуется раствор алюминатов натрия и калия и шлам СаSiO3:
NаАlО2 + КАlО2 + 4Н2O = Nа[Аl(ОН)4] + К[Аl(ОН)4]
в) через раствор алюминатов пропускают образовавшийся при спекании
СО2:
Nа[Аl(ОН)4] + К[Аl(ОН)4] + 2СО2 = NаНСО3 + КНСО3 + 2А1(ОН)3
г) нагреванием АlОН)3 получают глинозем:
2Аl(ОН)3 = Аl2О3 + 3Н2О
д) выпариванием маточного раствора выделяют соду и поташ, а ранее полученный шлам СаSiO3 идет на производство цемента.
При производстве 1 т Аl2О3 получают 1 т содопродуктов и 7,5 т цемента. Таким образом, комплексная переработка дешевого нефелина с помощью дешевого известняка дает возможность получить такие ценные продукты, как глинозем, сода (поташ) и цемент. За разработку этого метода группе ученых и инженеров в 1957 г. была присуждена Ленинская премия.
Из алюмосиликатов большой интерес представляют цеолиты. Их состав выражают формулой МxЭyО2y×nН2О, где М - Са, Na. (реже Ва, Sr, К), Э—Si иАl в переменном соотношении. На рис. 7 приведена модель одного из искусственных цеолитов. Кремнекислородные и алюмокислородные тетраэдры объединены в полиэдры, которые соединены друг с другом через атомы кислорода. Благодаря такому строению в кристаллах цеолитов имеются свободные полости определенных размеров.
В этих полостях располагаются ионы М+ и М2+, компенсирующие отрицательный заряд алюмокремнекислородных тетраэдров, и в них могут внедряться молекулы воды. Содержание воды зависит от давления водяного пара. Цеолиты способны обменивать воду на другие вещества (спирт, аммиак и т. л.). При осторожном нагревании вода постепенно удаляется, и даже полное обезвоживание не приводит к разрушению кристаллической решетки цеолита.
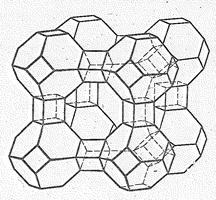
Рис. 7 Структура цеолита.
Ряд искусственных цеолитов используется в качестве так называемых молекулярных сит. Молекулярные сита поглощают вещества, молекулы которых могут войти в их полости (диаметром 0,3—1,3 нм), Например, одно из молекулярных сит (с диаметром отверстия 0,35 им) может поглотить молекулы Н2, О2, N2, но практически не поглощает более крупные молекулы типа СН4 или атомы Аr. Молекулярные сита используются для разделения углеводородов, осушки газов и жидкостей.
В цеолитах одни катионы могут замещаться другими. На этом свойстве основано применение цеолитов в качестве ионообменников (катионитов). Цеолиты с внедренными в них ионами ряда d -элементов являются катализаторами.
Сульфид алюминия Аl2S3 получают непосредственным взаимодействием простых веществ при температуре красного каления, Это кристаллическое вещество (T. пл. 1100 °С), полностью гидролизующееся даже следами влаги в воздухе. При сплавлении Аl2S3 с основными сульфидами образуются полимерные сульфидоалюминаты состава М+1АlS2 и М+2(АlS2)2. Они малоустойчивы, в водных растворах легко разлагаются.
Галогениды алюминия АlНаl3 в обычных условиях — бесцветные кристаллические вещества. Их можно получить прямым взаимодействием простых веществ. Основной способ получения АlF3 основан на действии безводного HF на Аl2O3 или Аl:
Аl2O3 + 6НF = 2АlF3 + 3H2O
а получение АlСl3 на хлорировании Аl2O3 в присутствии угля (при 500—550°С).

Фторид алюминия резко отличается по свойствам от остальных его галогенидов. Имеет координационную решетку типа RеО3, тугоплавок, не растворяется в воде, химически неактивен. Хлорид имеет слоистую решетку, а кристаллы АlВr3 и АlI3 состоят из димерных молекул Аl2Наl6 (рис. 8).
Поэтому они легкоплавки, заметно летучи при обычной температуре. Очень гигроскопичны и на воздухе расплываются. Хорошо растворяются не только в воде, но и во многих органических растворителях.

Рис. 8 Строение молекулы Аl2Наl6.
В парообразном состоянии и в некоторых органических растворителях АlСl3, АlВr3 и АlI3 находятся в виде димерных молекул Аl2Наl6, имеющих конфигурацию сдвоенных тетраэдров с общим ребром (рис. 8). Простые молекулы АlНаl3 существуют только при высокой температуре, например Аl2Сl6 диссоциирует на молекулы АlНаl3 при 700 °С.
В отличие от типичных солей галогениды алюминия (кроме АlF3) — весьма реакционноспособные вещества. Взаимодействие АlНаl3 с водой сопровождается значительным выделением тепла. При этом они сильно гидролизуются, но в отличие от типичных кислотных галогенидов неметаллов их гидролиз неполный и обратимый.
Подобно ВНаl3 тригалогениды алюминия (кроме АlF3) — сильные акцепторы электронных пар — присоединяют молекулы-доноры, например:

|  Рис. 9. Структура криолита Nа3АlF6.
Рис. 9. Структура криолита Nа3АlF6.
|
Склонность к комплексообразованию у АlНаl3 проявляется в отношении к Н2O, Н3N, РСl5, РОСl3 и ряду органических соединений. С этой способностью связано применение АlСl3 в качестве катализатора в органическом синтезе.
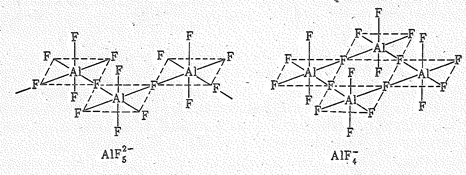
С основными галогенидами АlНаl3 легко образуют галогеноалюминаты типа М+13АlF6, М+12АlF5 и М+1АlHаl4. Из них наиболее устойчив гексафтороалюминат натрия Nа3АlF6 (криолит). Его кристаллы островного типа образованы ионами Nа+ и АlF63- (рис. 9). Фтороалюминаты состава М+12АlF5 и М+1АlF4 образованы полимерными фтороалюминатными комплексами. Так, в кристалле Тl2АlF5 октаэдры АlF6 за счет двух своих вершин (атомов F) объединены в бесконечные цепи состава АlF52-, а в КАlF4 октаэдры АlF6 за счет четырех вершин образуют бесконечный анион AlF4- в виде сетки.
Объединение же октаэдров АlF6 за счет всех шести вершин создает координационную кристаллическую решетку АlF3 (см. выше).
Фтороалюминаты щелочных металлов в воде раствворяются с трудом. Наибольшее применение (для получения Аl, F2, эмалей, стекла и пр.) имеет Nа3АlF6. Промышленное производство искусственного криолита основано на обработке гидроксида алюминия плавиковой кислотой и содой:
2Аl(ОН)3 + 12НF + 3Nа2СО3 = 2Nа3АlF6 + 3СO2 + 9Н2O
В хлоро, бромо- и иодоалюминатах координайионное число Аl равно четырем. Получаются они при сплавлении тригалогенидов алюминия с галогенидами соответствующих металлов. Производные щелочных металлов, например Nа[АlСl4] (T. пл. 156 °С); Сs[АlСl4] (T. пл, 377 °С), являются солями. В противоположность фторалюминатным ионам ионы [АlСl4]-, [АlВr4]- и [АlI4]- легко гидролизуются, поэтому соответствующие соли в воде разлагаются,
Алюминий образует полимерный гидрид (алан) АlН3, который получают косвенным путем, например действием АlСl3 на эфирные растворы гидридоалюминатов:
Li[АlН4] + АlСl3 = 4АlН3 + 3LiСl
Гидрид алюминия (АlН3)n — белый порошок, разлагающийся при температуре выше 105 oС с выделением водорода. Подобно гидрадам бора АlН3 — соединение с дефицитом электронов. Предполагается, что он имеет сетчатое строение. Атомы алюминия находятся в октаэдрическом окружении атомов водорода и каждая пара соседних атомов алюминия связана двумя трехцентровыми двухэлектронными связями через атомы водорода сверху и снизу от плоскости сетки из атомов алюминия. Фрагмент структуры АlН3 показан на рис. 10.
При взаимодействии эфирного раствора АlН3 с основными гидридами образуются гидридоалюминаты:
LiН + АlН3 = Li[АlН4]
 а а
|  б
б
|
Рис.10 а) Фрагмент структуры гидрида алюминия (АlН3)n
б) Структура Al(BH4)3
Гадридоалюминаты — белые твердые вещества. Их устойчивость заметно меньше однотипных гидридоборатов. Водой бурно разлагаются. Они сильные восстановители. Применяются (в особенности Li[АlН4]) в органическом синтезе.
В качестве, смешанного гидрида бора-алюминия можно рассматривать гидридоборат алюминия Аl[ВН4]3 (T. пл. —64,5 °С, т. кип. 44,5 °С). Это соединение также с дефицитом электронов. Связь атомов бора и алюминия осуществляется через водород двумя трехцентровыми двухэлектронными связями (рис. 10б). Аl[ВН4]3 можно получить по обменной реакции в эфирной среде:
3Nа[ВН4] + АlСl3 = Аl[ВН4]3 + 3NаСl
Аl[ВН4]3 чрезвычайно реакционноспособен. Перспективен как ракетное топливо.
 Для алюминия, как и для бора, известны соединения, которые по структуре аналогичны соответствующим соединениям углерода. Например;
Для алюминия, как и для бора, известны соединения, которые по структуре аналогичны соответствующим соединениям углерода. Например;
Указанные производные алюминия менее устойчивы, чем однотипные соединения бора. Некоторые из них известны лишь при низких температурах в полимеризованном состоянии.
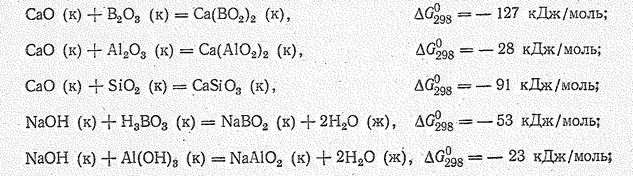 Приведенный обзор показывает, что по сравнению с бором у алюминия признаки металлического элемента заметно усиливаются. В частности, в отличие от кислотных соединений бора однотипные соединения алюминия (III) проявляют амфотерные свойства. Ослабление кислотных признаков однотипных производных алюминия (III) по сравнению с бором (III), а также у алюминия (III) по сравнению с кремнием (IV) можно проиллюстрировать на следующих примерах:
Приведенный обзор показывает, что по сравнению с бором у алюминия признаки металлического элемента заметно усиливаются. В частности, в отличие от кислотных соединений бора однотипные соединения алюминия (III) проявляют амфотерные свойства. Ослабление кислотных признаков однотипных производных алюминия (III) по сравнению с бором (III), а также у алюминия (III) по сравнению с кремнием (IV) можно проиллюстрировать на следующих примерах:
 Из значений DG приведенных реакций следует, что соединения алюминия (Аl2O3, Аl(ОН)3, АlF3, АlН3) имеют более основные свойства, чем однотипные соединения бора (В2О3, Н3ВО3, ВF3, В2Н6) и кремния (SiO2, SiF4).По сравнению же с соединениями Мg (II) соединения А1(III) проявляют более кислотные свойства.
Из значений DG приведенных реакций следует, что соединения алюминия (Аl2O3, Аl(ОН)3, АlF3, АlН3) имеют более основные свойства, чем однотипные соединения бора (В2О3, Н3ВО3, ВF3, В2Н6) и кремния (SiO2, SiF4).По сравнению же с соединениями Мg (II) соединения А1(III) проявляют более кислотные свойства.
[1] Восстановление металла из его оксида с помощью другого металла называется металлотермией. Если, в частности, применяется алюминий, то процесс называется алюмотермией (могут применяться магний, кремний).
[2]Карборунд SiC – кубическая (алмазоподобная) и тригональная модификации. Эльбор BN - кристаллическая решетка типа алмаза.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 4105; Нарушение авторских прав?; Мы поможем в написании вашей работы!