
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энтропия
|
|
|
|
Энтропия (S) – термодинамическая функция состояния, которая служит мерой беспорядка (неупорядочности) системы. Возможность протекания эндотермических процессов обусловлена изменением энтропии, ибо в изолированных системах самопроизвольно протекающего процесса увеличивается  S
S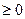 (второй закон термодинамики). S=R*lnW
(второй закон термодинамики). S=R*lnW
Размерность энтропии 1 моля вещества совпадает с размерностью газовой постоянной R и равна Дж*моль -1 S
 S
S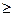 Q/T и
Q/T и S=Q/T
S=Q/T
Для химической реакции изменение энтропии аналогично энтальпии термин был введен Клаузиусом (1985 г.) через отношение Q/T (приведенное тепло).
dS = dQ/T
где dS –дифференциал энтропии; dQ-дифференциал теплоты; Т- абсолютная температура;
Это формула является математическим выражением классической формулировки 2 закона термодинамики, который гласит, что для всех обратимых изменений в закрытой системе с однородной температурой справедливо соотношение
dS = dQ/T
Для всех необратимых изменений в закрытой системе величина приращения энтропии будет больше, чем изменение приведенной теплоты, то есть
dS 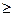 dQ/T
dQ/T
При чем знак равенства имеет место при обратимых процессов, а неравенства – при необратимых процессах.
Запишем формулировку второго закона термодинамики:
У всякой изолированной системы, находящейся в неравновнсном состоянии, энтропия с течением времени возрастает, ее рост продолжается до тех пор,пока система не достигнет равновесного состояния.
Связь энтропии и термодинамических параметров.
Расчет изменении температуры системы



Изменение энтропии вещества, температура которого, повышается при постоянном обьеме от Т1 до Т2, вычесляют путем интегривования частной производной энтропии по температуре при постоянном обьеме
(dS/dT) = Cv/T
Где Cv- изохорная теплоемкость системы, Дж/К
Если в системе в указанном диапазоне температур не происходит каких либо фазовых превращений, то интегривование приводит к:
S(V,T2) – S(V,Т1)= Cv(T)/dT
Система характеризуется, кроме того, такими свойствами как внутренняя энергия U, энтальпия S,энергия Гиббса G. Из изменение в ходе химических реакций характеризуют ее энергетику системы.Перечисленные свойства системы зависят от температуры, давления,концентрации, поэтому они называются функциями состояния, не зависят от пути процесса и определются только конечным и начальным состояниями системы.
Изохорический процесс характеризуется постоянством обьема. Следовательно, V = const, dV =0; поэтому
dA =0
Поскольку этот процесс протекает в замкнутом пространстве, то расширение и связанная с ним работа отсутствуют.В этом случае первое начало термодинамики
dQ =dU+ dA
приобретает вид
dQ =dU или Q= U
U
т.е. убыль внутренней системы обращается в теплоту, выделяющуюся при протекании процесса, или, наоборот, вся поглощенная теплота тратится на приращение энергии.
Изобарический процесс характеризуется постоянством давления. Следовательно, выражение dA = pdV после интегрирования при условии
p = const приобретает вид:
A = p (V2 –V1)
Работа, совершаемая при этом процессе, пропорциональна изменению обьема газа.
A = R (T2- T1)
Работа изобарического процесса пропорциональна изменению температуры газа.
Изотермический процесс характеризуется постоянством температуры. Следовательно, dA = pdV, но, согласно уравнению pV/T = R, p = RT/V поэтому
dA= RT/V dV
Интегрируя это уравнение и полагая T =const получаем
A = RTln V2/V1
По закону Бойля –Мариотта V2/V1= p1/p2; поэтому
A = RTln p1/p2
То уравнение первого начало термодинамики (T= const и  U=0) приобретает вид: Q=A
U=0) приобретает вид: Q=A
Это означает что при изотермическом процессе работа, совершаемая над системой, полностью превращается в теплоту, которую система выделяет в окружающее пространство.
Адиабатический процесс характеризуется выражением dQ =0. Следовательно, уравнение первого начало термодинамики в этом случае имеет вид dU +dA =0 или dA = -dU Так как dU = CvdТ, то dA = -CvdT
Интегрирование дает следующую зависимость:
A = -Сv(T1-T2)
Согласно этому уравнению, работа адиабатического процесса пропорциональна изменению температуры газа, а также пропорциональна его теплоемкости при постоянном обьеме.
Теплоемкость представляет собой одну из наиболее важных характеристик вещества.
Из уравнения первого начала термодинамики dQ =dU+ dA
Следует, что
dQ/dT=dU/dT+ dA/dT
C = dQ/dT = dQ/dt
Называется теплоемкостью.Теплоемкость показывает, какое количество теплоты необходимо подвести к телу для заданного повышения его температуры. В данном случае величина теплоемкости определена как количество теплоты, которое необходимо для дифференциально малого изменения степени нагретости тела. Это так называемая истинная теплоемкость.
Часто используется величиной средней теплоемкости
C= Q/t2 –t1
Легко видеть, что средняя теплоемкость равняется количеству теплоты, необходимиое для нагревания тела на 1о ,причем t2 и t1 конечное и начальное значения температуры тела.
Если t1 = ОоС, а t2 принимает значения t, то уравнение упрощается:
C = Q/t
И величина С носит название средней теплоемкости в интервале температур от 0 до tоС.Поскольку величина Q зависит от пути процесса, то от него также будет зависеть и величина теплоемкости. Чаще всего используется теплоемкость при постоянном обьеме Сv и теплоемкость при постоянном давлении Ср,т.е.
Сv = (dU/dT)v= dQv/dT
Сp = (d Н/ dT)p =dQp/dT
Температурная зависимость теплоемкостей.
При повышении температуры теплоемкость резко возрастает.Если уравнение истинной теплоемкости имеет вид
С= 
C = a+bt+ct2
То связь коэффициентов
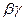 с коэффициентами а,б,с
с коэффициентами а,б,с  выражается соотношениями:
выражается соотношениями: 
А=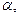 b=
b= /2; c=
/2; c= 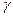 /3 или
/3 или 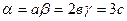 .
.
Зависимость теплоемкости от температуры для практических расчетов выражают обычно эмперическими формулами в виде степенных рядов от температуры:
С=a + bT+ cT2 + dT3 или C= a +bT + cT-2
Для определия средней теплоемкости по истинной пользуется соотношениями:C = 1/t –t1 Cdt;
C = 1/T –T1 CdT Количество теплоты, затраченное на нагревание n молей вещества от Т1 до Т2, определяется соотношений:
Количество теплоты, затраченное на нагревание n молей вещества от Т1 до Т2, определяется соотношений:
Qv =  U = n CvdT = nCv(T2-T1)
U = n CvdT = nCv(T2-T1)
Qp = H = n Cp dT = n Cp(T2-T1)
H = n Cp dT = n Cp(T2-T1)
Учитывая, что теплоемкость является функцией температуры, для расчета количества теплоты используют уравнение
Qp = n[ a(T2 – T1)+ ½ b (T22 –T12)+ C/ T2-T1/T1T2] Температурная зависимость теплоемкостей.
При повышении температуры теплоемкость резко возрастает.Если уравнение истинной теплоемкости имеет вид
С= 
C = a+bt+ct2
То связь коэффициентов
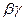 с коэффициентами а,б,с
с коэффициентами а,б,с  выражается соотношениями:
выражается соотношениями: 
А=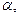 b=
b= /2; c=
/2; c= 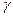 /3 или
/3 или 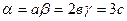 .
.
Зависимость темплоемкости от температуры для практических расчетов выражают обычно эмперическими формулами в виде степенных рядов от температуры:
С=a + bT+ cT2 + dT3 или C= a +bT + cT-2
Для определия средней теплоемкости по истинной пользуется соотношениями:C = 1/t –t1 Cdt;
C = 1/T –T1 CdT Количество теплоты, затраченное на нагревание n молей вещества от Т1 до Т2, определяется соотношений:
Количество теплоты, затраченное на нагревание n молей вещества от Т1 до Т2, определяется соотношений:
Qv =  U = n CvdT = nCv(T2-T1)
U = n CvdT = nCv(T2-T1)
Qp = H = n Cp dT = n Cp(T2-T1)
H = n Cp dT = n Cp(T2-T1)
Учитывая, что теплоемкость является функцией температуры, для расчета количества теплоты используют уравнение
Qp = n[ a(T2 – T1)+ ½ b (T22 –T12)+ C/ T2-T1/T1T2]
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1314; Нарушение авторских прав?; Мы поможем в написании вашей работы!