
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Второе начало термодинамики. Энтропия
|
|
|
|
Выражая всеобщий закон сохранения и превращения энергии, первое начало термодинамики не позволяет определить направление протекания термодинамических процессов. Прежде всего необходимо расширить представления о термодинамических процессах введения понятия о обратимом и необратимом процессе.
Термодинамический процесс, совершаемый системой, называется обратимым, если после него можно возвратить систему и все взаимодействующие с ней тела в их начальные состояния таким образом, чтобы в других телах не возникло каких-либо остаточных изменений. Процессы, которые не удовлетворяют вышеуказанным условиям, называются необратимыми.
В природе нет ни одного процесса, который был бы полностью обратимым. Рассмотрим идеализированный пример. В комнате, при поддержании постоянной температуры, стоит идеальный цилиндр с поршнем (поршень скользит без трения, утечки между поршнем и цилиндром нет), под поршнем которого находится идеальный газ. Бросаем на поршень гирю, массы m. Под действием гири поршень опустится, и газ в цилиндре сожмется и нагреется. Процесс можно считать близким к адиабатическому. Дождемся теплового равновесия между системой и комнатой. Теплота сжатия уйдет в окружающее пространства комнаты. Затем, убираем гирю. Поршень поднимется и газ остынет. После теплообмена с атмосферой комнаты и наступления теплового равновесия, поршень подымится. Система не вернется в первоначальное положение, поскольку атмосферу комнаты, можно условно считать термостатом. Теплота сжатия уйдет частично за пределы помещения исходя из условия равновесия теплового излучения с веществом. Процесс в этом случае будет необратимым. Если гирю массой m заменить горкой мелкого песка и по песчинке накладывать на поршень, дожидаясь теплового равновесия системы. Аналогично, по песчинке, после того как вся масса песка будет переложена на поршень, снимать песок с поршня. При этом количество тепла, выделяющееся или поглощающееся, при накладывании или убирании песчинки будет очень мало и отвод его за пределы комнаты будет практически равен нулю. И процесс будет обратимым. Соответственно, любой процесс можно сделать из необратимого обратимым проводя его бесконечно долго.
|
|
|
За меру близости реального процесса к обратимому в водят понятие энтропии системы. Приращение энтропии системы определяется соотношением:
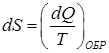 . .
| (82) |
При обратимом процессе приращение энтропии  ; при необратимом –
; при необратимом – 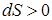 , поскольку приращение количества теплоты при необратимом процессе положительно. Последнее выражает философский закон возрастания энтропии. Из соотношения (82) и закона возрастания энтропии следует положительная термодинамическая шкала температур. Выясним из закона Больцмана энтропию элементарного теплового выброса:
, поскольку приращение количества теплоты при необратимом процессе положительно. Последнее выражает философский закон возрастания энтропии. Из соотношения (82) и закона возрастания энтропии следует положительная термодинамическая шкала температур. Выясним из закона Больцмана энтропию элементарного теплового выброса:
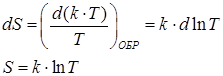 . .
| (83) |
Энтропия элементарного теплового выброса является функцией логарифма температуры, а температура, в свою очередь, определяет скорость молекул. Следовательно, физический смысл энтропии – мера беспорядка в системе. Чем выше температура, тем система более неупорядочена.
Из первого начала термодинамики и уравнения Менделеева–Клайперона, можно вычислить приращение энтропии:
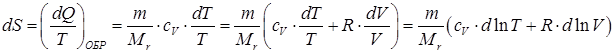 . .
| (84) |
В обратимом процессе переход идеального газа из одного состояния в другое не зависит об вида процесса, интегрируя выражение (84) получаем энтропию при обратимом процессе:
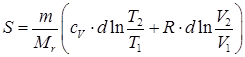 . .
| (85) |
Из (85) следует, что при любом обратимом термодинамическом процессе (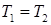 и
и 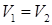 ) приращение энтропии тождественно равно нулю:
) приращение энтропии тождественно равно нулю:
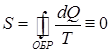 . .
| (86) |
Круговым процессом или круговым циклом называется совокупность термодинамических процессов, в результате которых система возвращается в первоначальное состояние. Тело, совершающее круговой процесс и обменивающееся энергией с другими телами, называется рабочим телом. Обычно таким телом является газ. Круговой процесс, проводимый над газом, является полностью обратимым. Следовательно, по первому началу термодинамики количество теплоты, сообщаемое газу в круговом процессе равно работе, совершаемый за цикл рабочим телом.
|
|
|
Рассмотрим тепловой двигатель, рабочим телом которого является идеальный газ, совершающий круговой процесс. Коэффициентом полезного действия теплового двигателя называют отношение полезной работы к подведенному к газу теплу:
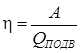 . .
| (87) |
Из всех изученных процессов, согласно первому началу термодинамики наибольшая работа совершается при изотермическом и адиабатическом процессах. При изотермическом процессе, изменение внутренней энергии равно нулю, и все тепло идет в работу. При адиабатическом процессе – тепло к газу не подводится, и работа совершается за счет внутренней энергии. Следовательно, тепловая машина с наибольшим коэффициентом полезного действия должна быть построена на круговом процессе, состоящем их двух изотерм и двух адиабат, без увода рабочего тела за пределы тепловой машины. Такая тепловая машина называется тепловой машиной Карно. Термодинамическая диаграмма тепловай машины Карно, в координатах энтропия–температура, приведена на рис. 11.
 T
T


 T 1 1 2
T 1 1 2
 T 2 4 3
T 2 4 3
 0 S 1 S 2 S
0 S 1 S 2 S
Рис. 11. Термодинамическая диаграмма цикла Карно
Газ на участке 1–2 находится в термостате при температуре T 1, называемой температурой нагревателя – TН. При этом газ забирает тепло из термостата, совершая работу. На 2–3 газ расширяется адиабатически, совершая работу. На участке 3–4, газ приводится в взаимодействие с другим телом, называемым холодильником и изотермически сжимается, отдавая тепло холодильнику, при температуре T 2, называемой температурой холодильника – TХ. В состоянии 4–1 газ адиабатически сжимается до температуры нагревателя и передается в нагреватель.
Работа, совершаемая газом, по первому началу термодинамики и определению энтропии, определяется площадью, ограниченной кривой термодинамической диаграммы энтропия–температура: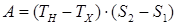 . Подведенное к газу количество теплоты в нагревателе –
. Подведенное к газу количество теплоты в нагревателе –  . Тогда термодинамический коэффициент полезного действия тепловой машины Карно:
. Тогда термодинамический коэффициент полезного действия тепловой машины Карно:
|
|
|
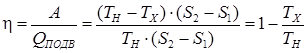 . .
| (88) |
Термодинамический коэффициент полезного действия тепловой машины зависит только от температур нагревателя и не зависит от рабочего тела и является предельным для любого теплового двигателя.
Исходя из закона возрастания энтропии при необратимом процессе, можно сформулировать второе начало термодинамики: невозможен термодинамический процесс, единственным результатом которого является теплоты от холодного тела к горячему, или невозможен термодинамический процесс, единственным результатом которого является совершение работы за счет охлаждения одного тела.
Второй закон термодинамики запрещает создание так называемого вечного двигателя второго рода, работающего за счет охлаждения одного единственного тела. Температура такого тела в конечном счете станет равной абсолютному нулю.
В случае обратимых процессов из первого начала термодинамики выполняется термодинамической тождество:
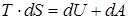 , ,
| (89) |
которое можно переписать в виде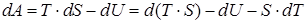 или
или 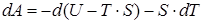 . Величина, стоящая под дифференциалом будет функцией состояния системы
. Величина, стоящая под дифференциалом будет функцией состояния системы
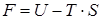 , ,
| (90) |
называется энергией Гельмгольца, или свободной энергией. Убыль энергии Гельмгольца при обратимом изотермическом процессе равна работе, совершаемой телом при этом процессе.
2.8. Уравнение Ван-дер-Ваальса
Реальные газы и пары далеки по своим свойствам от идеальных газов. Во-первых, молекулы газа имеют конечные размеры и материальными точками их считать невозможно. Во-вторых, во всех реальных газах присутствуют силы межмолекулярного взаимодействия и они не абсолютно упругие. В-третьих, в виду действия сил межмолекулярного притяжения реальные газы при определенных значениях температур и давлений существуют в конденсированном (жидком) состоянии.
|
|
|
Впервые, учет сил межмолекулярного взаимодействия был проведен Ван-дер-Ваальсом, в результате левая часть уравнения Менделеева–Клайперона была изменена. Приводим лишь некоторые рассуждения доказательства уравнения Ван-дер-Ваальса.
Уравнение Менделеева–Клайперона моля для реального газа, запишем в эффективных давлениях и объемах: 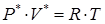 . Смысл эффективных давлений и объемов следующий: эффективные давление и объем моля реального газа, это такие значения величин молярного давления и объема для реального газа, которые равны давлению и объему моля идеального газа при данной температуре.
. Смысл эффективных давлений и объемов следующий: эффективные давление и объем моля реального газа, это такие значения величин молярного давления и объема для реального газа, которые равны давлению и объему моля идеального газа при данной температуре.
Во-первых, в виду наличия конечных размеров молекул, молярный объем реального газа будет больше идеального. Поскольку рассматриваем однокомпонентный газ, а не смесь газов, то поправка в молярный эффективный объем будет константой для данного газа и зависеть от размера молекулы, т.к. размеры всех молекул одинаковы. Тогда 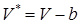 , где b – константа.
, где b – константа.
Во-вторых, давление реального газа будет меньше давления идеального газа. Поправка в давление реального газа, в отличие от идеального, обуславливается наличием сил межмолекулярного притяжения и зависит только от химической природы газа: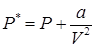 , где a – константа. На самом деле, для реальных газов константы Ван-дер-Ваальса можно считать примерно постоянными для многих газов в области температур их существования как неионизированных газов.
, где a – константа. На самом деле, для реальных газов константы Ван-дер-Ваальса можно считать примерно постоянными для многих газов в области температур их существования как неионизированных газов.
Подставляя в уравнения Менделеева–Клайперона эффективные молярные давления и объем, получаем молярное уравнение Ван-дер-Ваальса:
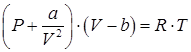 , ,
| (91) |
или для произвольной массы газа
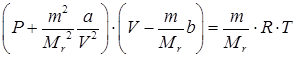 . .
| (92) |
Уравнение Ван-дер-Ваальса позволяет объяснить существование газа в конденсированном состоянии только ниже некоторых давлений, объемов и температур, называемых критическими. Выше этих значений, согласно уравнению (92) газ нельзя сжижить.
Для нахождения критических значений нужно взять производную уравнения (92) слева и справа и рассмотреть изопроцессы. Без доказательства приводим формулы расчета критических величин:
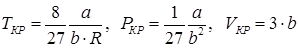 . .
| (93) |
ПРИЛОЖЕНИЕ
НЕКОТОРЫЕ СВЕДЕНИЯ ИЗ РАЗДЕЛОВ МАТЕМАТИКИ
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 659; Нарушение авторских прав?; Мы поможем в написании вашей работы!