
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 2Равновесия в гомогенной и гетерогенной системах. Гравиметрический метод анализа
|
|
|
|
2. 1 Равновесие в гомогенных системах.
Гомогенными системами называются те, которые содержат одну фазу: жидкую, газообразную, твердую. Например, растворы кислот, щелочей, солей или смесь газов.
2. 1. 1. Равновесие в воде и растворах электролитов.
Сама вода является слабым электролитом:
 ,
, 
правильнее 
По закону действия масс: 
В нейтральном растворе: 
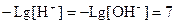 pH=7
pH=7
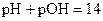
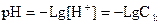

В растворах сильных электролитов (сильные кислоты, щелочи, соли) существуют только ионы (простые и сольватированные, молекул нет).
В растворах слабых электролитов 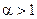 , степень диссоциации зависит от природы электролита и прежде всего от константы диссоциации. Так, для кислоты HАn:
, степень диссоциации зависит от природы электролита и прежде всего от константы диссоциации. Так, для кислоты HАn:


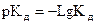
Кд – характеризует силу кислот и оснований, чем она больше, тем сильнее кислота или основание.
В растворах слабых электролитов присутствуют как молекулы, так и ионы.
2. 1. 2 Равновесие в растворах гидролизующихся солей.
Гидролизом называют реакцию взаимодействия ионов солей с водой. Этот процесс обратимый. Каждое в-во подвергнутое гидролизу имеет две характеристики:  - степень гидролиза, Кгидр. – константа гидролиза.
- степень гидролиза, Кгидр. – константа гидролиза.
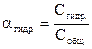
Если соль образованна сильной кислотой и слабым основанием, то среда раствора кислая, рН<7
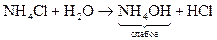 , рН<7
, рН<7
Если соль образованна слабой кислотой и сильным основанием, то среда щелочная.
 , рН>7
, рН>7
Если соль образованна слабой кислотой и слабым основанием то рН среды зависит от констант диссоциации кислоты и основания:


Формулы для вычисления [H+] и [OH-]
| Электролит | [H+] | [OH-] |
| Вода | 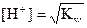
| 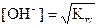
|
| Сильная кислота | 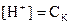
| 
|
| Сильное основание | 
| 
|
| Слабая кислота | 
| 
|
| Слабое основание | 
| 
|
2. 2 Равновесие в гетерогенной системе
Гетерогенными называются системы, которые содержат несколько фаз. Например, осадок-раствор, раствор-газ и т.д. Рассмотрим систему осадок-раствор в перенасыщенном растворе хлорида серебра. Насыщенным называется раствор, который максимальное количество вещества, которое может раствориться при определенной температуре. Перенасыщенным раствором называют такие растворы, которые содержат большее количество растворенного вещества, чем соответствует его нормальной температуре. Примером гетерогенной системы является система осадок-раствор.
В системе осадок AgCl – раствор осадок находится в равновесии с его раствором. Схему равновесия можно изобразить следующим образом:

Термодинамическая константа этого равновесия называется произведением активности:
 ,
,
где a – активность, т.е. это та концентрация, которую бы имел компонент в идеальном растворе  .
.
В общем виде для осадка состава АmBn:
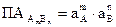 ,
,
где aA и aB – это активности ионов A+ и B-.
Активность 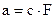 ,
,
где F – коэффициент активности, он служит мерой электростатических взаимодействий в системе.
Для разбавленных растворов ( ), а=с F=1.
), а=с F=1.
Для концентрированных растворов  и
и 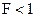 .
.
Значение коэффициентов активности рассчитывают по формуле:
1) если 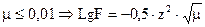 .
.
2) если 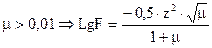 , где z – заряд иона, µ - ионная сила раствора.
, где z – заряд иона, µ - ионная сила раствора.
Ионная сила раствора отражает электрическое взаимодействие между всеми ионами в растворе. Она зависит от концентрации и заряда всех ионов, присутствующих в растворе. Для раствора содержащего ионы А и В ионная сила раствора рассчитывается по формулам:
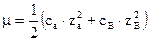 ,
,
где са и сВ – это концентрации ионов А и В в 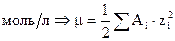 .
.
Из выражения для произведения растворимости следует правило произведения растворимостей: «Произведение активностей ионов в насыщенном растворе малорастворимого электролита есть величина постоянная для данного растворителя, и давления».
Если произведение активностей больше или равно ПА, то в системе выпадает осадок, если меньше, то осадок не выпадает. Если  , то осадок выпадает.
, то осадок выпадает.
В реальных системах вместо активности удобнее пользоваться концентрациями, поэтому правило произведения растворимостей для АmВn записывается так:
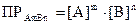
Связь между ПА и ПР выражается формулой:

2. 3 Растворимость осадков.
Растворимостью называется общая концентрация вещества в его насыщенном растворе. Растворимость рассчитывается по формулам для АmВn:
Для разбавленных растворов без учета μ, если F=1:
 ;
;
Для концентрированных растворов с учетом μ, F<1:
 .
.
2. 4 Группы методов количественного анализа
Принято делить методы анализа на три большие группы:
1) химические методы анализа - когда данные получаются в результате выделения осадка, выделения газа, изменения цвета окраски;
2) физико-химические методы анализа - может быть зафиксировано какое-нибудь физическое или химическое изменение величин;
3) физические методы анализа
К химическим методам относят:
- гравиметрический (весовой) анализ
- титриметрический (объемный) анализ
- газоволюмометрический анализ
К физико–химическим методам относят все способы инструментального анализа:
- фотоколориметрический
- спектрофотометрический
- нефелометрический
- потенциометрический
- кондуктометрический
- полярографический
К физическим относятся:
- спектральный эмиссионный
- радиометрический (метод меченых атомов)
- рентгеноспектральный
- люминесцентный
- нейтронно-активизационный
- эмиссионный (пламенная фотометрия)
- атомно-абсорбционный
- ядерно-магнитный резонанс
2. 5 Основы гравиметрического (весового) метода анализа
Гравиметрический анализ основан на точном измерении массы определяемого вещества в виде соединения или простого вещества определенного состава. Основным инструментом являются весы.Гравиметрия является абсолютным методом анализа, так как измеряемый аналитический сигнал сразу же дает количество определяемого компонента при условии полноты превращения и чистоты выделенного вещества.
Гравиметрия является наиболее простым, точным, хотя и продолжительным методом анализа. При анализе простых образцов с содержанием определяемого компонента свыше 1 % точность гравиметрического анализа редко удается превзойти с помощью других методов. Гравиметрические методы широко применяются для количественного определения неорганических и органических веществ.
Гравиметрические методы подразделяются на две подгруппы:
I. методы осаждения
II. методы отгонки.
В методах отгонки определяемый компонент выделяют из пробы в виде летучего соединения с последующим определением массы отогнанного вещества (прямое определение) или массы остатка (косвенное определение). Поскольку методы отгонки базируются на летучести определяемых компонентов, они не универсальны и малочисленны.
Наибольшее значение в гравиметрии имеют методы осаждения. В методе осаждения определяемый компонент количественно осаждают химическими способами в виде малорастворимого химического соединения строго определенного состава (форма осаждения). Выделившийся осадок промывают, высушивают и прокаливают. При этом осадок большей частью превращается в новое вещество точно известного состава, которое взвешивают на аналитических весах (гравиметрическая форма).
Гравиметрическая форма может иметь ту же формулу, что и форма осаждения. Например, при определении сульфат-ионов гравиметрическим методом путем осаждения их ионами бария формула формы осаждения (осадка) и формула гравиметрической формы при соблюдении всех требуемых условий анализа одна и та же. Схема этого определения представляется следующим образом:
SO 42- 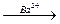 BaSO4
BaSO4 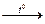
 BaSO4.
BaSO4.
определяемое форма гравиметрическая
вещество осаждения форма
В некоторых гравиметрических методах определения путем осаждения формула гравиметрической формы отличается от формулы осадка. Например, при определении ионов железа, осаждаемых в виде гидроокиси, схема определения следующая:
2 Fe3+

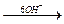
 Fe(OH)3
Fe(OH)3  > Fe2O3
> Fe2O3
определяемое форма гравиметрическая
вещество осаждения форма
или для определения ионов кальция:
Ca2+ 
 CaC2O4
CaC2O4  >
> CaO.
CaO.
определяемое форма гравиметрическая
вещество осаждения форма
Твердая фаза выделяется из раствора благодаря различным по характеру, но параллельно протекающим процессам. К этим процессам относятся:
1) образование кристаллических зародышей или первичных кристаллов;
2) выделение твердой фазы на поверхности кристаллических зародышей;
3) объединение маленьких кристаллов в большие агрегаты.
Эти процессы могут идти двумя путями, которые определяют форму осадка, т.е. образование кристаллического или аморфного осадка.
Все перечисленные процессы происходят лишь при условии, если произведение концентраций (точнее активностей) соответствующих ионов превысит величину произведения растворимости осаждаемого соединения при данной температуре. Например, для труднорастворимого соединенияBaSO4:
[ Ba ]
]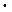 [SO4
[SO4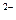 ] ³ ПРBaSO4 ³ 1,1
] ³ ПРBaSO4 ³ 1,1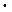 10
10 .
.
В этом случае раствор оказывается перенасыщенным относительно сульфата бария и начинается осаждение.
Целью процесса осаждения является наиболее полный перевод в осадок определяемой составной части анализируемого вещества. Поэтому необходимо четко знать причины, которые могут вызвать уменьшение или увеличение массы осадка. К уменьшению массы осадка приводят различные потери, являющиеся следствием:
1) обратимости реакции осаждения;
2) некоторой растворимости осадка;
3) прохождения мелких частиц осадка через фильтр;
4) перехода осаждаемого вещества в коллоидное состояние.
Увеличение массы осадка происходит от его загрязнения другими веществами. Данный процесс называют явлением соосаждения. Соосаждение включает в себя адсорбцию и окклюзию.
Адсорбция - осаждение примесей на поверхности осадка вследствие неравномерности электростатического поля иона внутри кристаллической решетки и на ее поверхности.
Окклюзия – это захват посторонних ионов в процессе образования осадка. Захват может осуществляться, во-первых, вследствие адсорбции ионов на поверхности растущих кристаллов (внутренняя адсорбция), во-вторых, в результате захвата маточного раствора, попадающего в трещины и полости в осадке (инклюзия) или за счёт образования химических соединений. Возможно также образование твердых растворов и изоморфное замещение ионов.
Основные средства предотвращения всех этих нежелательных процессов, приводящих к изменению массы осадка следующие:
1) в качестве осаждаемого следует выбирать тот ион, который образует осадок, обладающий наименьшей растворимостью;
2) растворимость того или иного малорастворимого электролита можно понизить, вводя в раствор его сильные электролиты, содержащие одноименные ионы, и используя избыток осадителя;
3) осаждение следует вести в присутствии коагулянтов, коагулируя коллоиды;
4) получать крупнокристаллические осадки;
5) поверхность осадка должна быть наименьшей;
6) осадки промывать, подвергать старению и повторному осаждению.
Таким образом, не всякий осадок удовлетворяет требованиям, предъявляемым к осадкам в гравиметрическом анализе. Малорастворимое вещество может быть пригодным для этих целей лишь в том случае, если оно практически нерастворимо, имеет постоянный состав и структуру, обеспечивает успешное выполнение с ним дальнейших операций фильтрования, промывания и превращения его в определенную гравиметрическую форму.
2. 6 Условия осаждения кристаллических осадков.
Осаждение необходимо вести из достаточно разбавленного раствора разбавленным раствором осадителя.
Осадитель необходимо прибавлять очень медленно, по каплям (особенно в начале осаждения).
При добавлении осадителя раствор необходимо непрерывно перемешивать во избежание пересыщений.
Осаждение необходимо вести из горячих растворов.
Отфильтровывать осадок необходимо только после охлаждения раствора.
При осаждении необходимо прибавлять вещества, повышающие растворимость осадка.
Однако, даже при соблюдении этих условий, помимо крупных кристаллов может получаться и некоторое количество мелких. Чтобы их стало меньше, осадок необходимо оставлять стоять несколько часов (или до следующего занятия) для созревания (старения). При созревании мелкие кристаллы растворяются и за их счет растут крупные.
2. 7 Оптимальные условия осаждения аморфных осадков
Осаждение аморфных осадков необходимо вести из горячих растворов и в присутствии коагулирующего электролита, т.к. они склонны к образованию коллоидных растворов.
Для предупреждения явления адсорбции осаждение аморфных осадков следует вести из концентрированных растворов.
После окончания осаждения к раствору с осадком необходимо прилить большой объем (до 100 см3) воды и смесь перемешать. При этом часть адсорбционных ионов перейдет в раствор.
Аморфный осадок не рекомендуется оставлять в соприкосновении с раствором, поэтому его отфильтровывают сразу после образования.
2. 8 Расчеты в гравиметрии
Расчет массы определяемого компонента в гравиметрии не вызывает затруднений, поскольку он базируется на законе сохранения стехиометрического состава. Прежде всего следует записать схему гравиметрического определения компонента, который может быть атомом, ионом или молекулой, для простоты назовем его А:
аА ® ® bAkBm,
определяемый весовая
компонент форма
где a и b - такие целые числа, которые уравнивают число атомов определяемого компонента в левой и правой частях: схемы гравиметрического анализа (в данном случае а = b-k).
В реальном эксперименте имеют дело с реальными количествами определяемого компонента и весовой формы. Естественно, что эти величины связаны между собой:
nА/nв.ф.= а/b, (1)
где nА - число молей определяемого компонента A,
nВ.ф. - число молей весовой формы.
Очевидно, что:
n=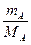 , nв.ф.=
, nв.ф.= 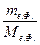 , (2)
, (2)
где mA - масса определяемого компонента, г;
MA - относительная молекулярная (ионная, атомная) масса определяемогокомпонента;
mВ.ф - масса весовой формы;
МВ.Ф. - относительная молекулярная масса весовой формы.
В итоге получаем, что
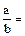
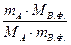 . (3)
. (3)
Тогда масса определяемого компонента равна:
mА=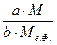 .mВ.Ф. (4)
.mВ.Ф. (4)
Константу, позволяющую пересчитать массу весовой формы в массу определяемого компонента, называют гравиметрическим или аналитическим фактором (множителем) F и вычисляют по формуле:
F= 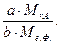 (5)
(5)
Вычисленный гравиметрический фактор также должен быть представлен числом с четырьмя значащими цифрами. В итоге расчет массы определяемого компонента по результатам гравиметрического анализа проводят по формуле:
mА = F. mВ.Ф. (6)
2. 9 Выбор осадителя в методе осаждения.
Осадитель – это вещество, которое переводит анализируемое вещество в осадок. При выборе осадителя необходимо знать ПР образующегося осадка. Выбирают такой осадитель, чтобы ПР образующегося осадка было минимально. Так, например Be2+ можно осаждать в виде BeCO3, BeCrO4, BeSO4. Поэтому в качестве осадителя выбирают Na2SO4 или H2SO4.
Для полноты осаждения приливают избыток осадителя, а не его точное количество по уравнению реакции. Кроме перечисленных требований осадитель должен отвечать еще 2 требованиям:
- быть специфичным, т.е. реагировать только с определенными ионами;
- быть легко летучим, чтобы его модно было удалить при прокаливании.
2. 10 Требование к осадкам.
Осадок образующийся в процессе осаждения называется формой осаждения или осаждаемой формой. После высушивания и прокаливания осадок превращается в гравиметрическую форму.
Гравиметрическая форма может иметь ту же форму, что и форма осаждения. Например, при определении SO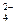 в растворе форма осаждения и гравиметрическая форма совпадают. В некоторых же случаях они не совпадают. Это зависит от растворимости веществ, которая в свою очередь зависит от произведения растворимостей, т.е. от природы вещества. В весовом анализе используют только такие осадки, у которых Р
в растворе форма осаждения и гравиметрическая форма совпадают. В некоторых же случаях они не совпадают. Это зависит от растворимости веществ, которая в свою очередь зависит от произведения растворимостей, т.е. от природы вещества. В весовом анализе используют только такие осадки, у которых Р .
.
Растворимость веществ, кроме того зависит и от других факторов, поэтому на неё можно влиять изменяя условии осаждения.
2. 11 Факторы, влияющие на растворимость.
1) Влияние одноименного иона.
Согласно правилу произведение растворимостей для соли АmBn если 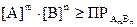 , то осадок выпадает. Если мы будем повышать концентрацию одного из компонентов, то
, то осадок выпадает. Если мы будем повышать концентрацию одного из компонентов, то  , тогда осадок будет выпадать гораздо раньше и растворимость осадка уменьшается. Таким образом при добавлении одноименного иона к осадку, его растворимость понижается. Поэтому при добавлении избытка осадителя к осаждаемому веществу, растворимость осадка уменьшается. В связи с этим в весовом анализе при осаждении какого либо иона приливают избыток осадителя (в 10-15 раз).
, тогда осадок будет выпадать гораздо раньше и растворимость осадка уменьшается. Таким образом при добавлении одноименного иона к осадку, его растворимость понижается. Поэтому при добавлении избытка осадителя к осаждаемому веществу, растворимость осадка уменьшается. В связи с этим в весовом анализе при осаждении какого либо иона приливают избыток осадителя (в 10-15 раз).
2) Влияние ионной силы  , увеличение ионной силы раствора приводит к уменьшению коэффициентов активности ионов осадка. Т.о. чем больше μ, тем больше Р осадка:
, увеличение ионной силы раствора приводит к уменьшению коэффициентов активности ионов осадка. Т.о. чем больше μ, тем больше Р осадка:  .
.
3) Влияние посторонних ионов на растворимость.
Если к раствору, содержащему осадок добавить какой-нибудь сильный электролит, то растворимость осадка повышается. Повышение растворимости осадка в присутствии сильных электролитов называется «солевым эффектом». Это явление объясняется тем, что в присутствии сильных электролитов повышается концентрация ионов в растворе, а следовательно ионная сила – увеличивается.
Это приводит к повышению коэффициентов активностей ионов, а следовательно к повышению растворимости осадка. Чем больше концентрация электролита, и чем больше заряд ионов, тем больше растворимость осадка.
4) Влияние концентрации ионов водорода (рН) на растворимость осадка.
Одним из важнейших факторов, влияния на растворимость является концентрация Н+, т.е. рН раствора.
Особенно рН раствора влияет на растворимость гидроокисей металлов. Чем больше концентрация Н+, тем больше растворимость гидроокисей. Такое же влияние оказывает рН раствора на растворимость солей, склонных к гидролизу, т.к. при их гидролизе в растворе образуются или кислоты или основания.
Изменение кислотностей среды оказывает влияние и на растворимость солей не склонных к гидролизу. Это связанно с тем, что кислоты являются сильными электролитами. Поэтому в присутствии большого избытка кислот возрастает μ, уменьшается F, а следовательно повышается растворимость осадка.
Таким образом, при выполнении весового анализа следует поддерживать определенное значение рН раствора.
5) Влияние конкурирующих реакций.
Ионы осадка могут вступать в реакции с компонентами раствора: наличие конкурирующих реакций всегда ведет к повышению растворимости осадка.
Особенно растворимость осадка изменяется в присутствии веществ, образующих с компонентами или анионами растворимые комплексы. Например, в присутствии ионов F-, осаждение Al3+ в виде гидроокиси никогда не бывает полным.
Т.о., чем выше концентрация F- в растворе, тем больше растворимость осадка Al(OH)3.
Многие осадки могут образовывать растворимые комплексы с одним из собственных ионов, образуя растворимые комплексы, таким образом, большой избыток осадителя иногда нежелателен
6) Влияние температуры и растворителя.
Температура и природа растворителя влияют на величину ПР, а следовательно на растворимость.
С ростом температуры растворимость малорастворимых осадков соединений как правило увеличивается. Это связанно с тем, что большинство твердых веществ растворяется с поглощением тепла. Поэтому осаждение осадков проводят при нагревании, а фильтрование осадков проводят при комнатной температуре или даже при охлаждении.
7) Природа растворителя также влияет на растворимость. Осадки, содержащие органические ионы лучше растворяются в органических растворителях. На этом основаны многие методы разделения веществ. Кроме того, для увеличения полноты осаждения неорганических веществ из водных растворов к ним добавляют органические растворители.
8) Влияние других факторов.
На растворимость осадков влияют и другие факторы. Так, например, чем меньше размер частиц осадка, тем больше его поверхность, а следовательно и растворимость. Поэтому в весовом методе стараются получить осадки с большим размером частиц. На растворимость также влияют форма кристаллов, плотность осадка и др.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1543; Нарушение авторских прав?; Мы поможем в написании вашей работы!