
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Потенциометрия
Классификация электрохимических методов анализа
Электрохимические методы анализа
Электрохимические методы основаны на измерении электрических параметров электрохимических явлений, возникающих в исследуемом растворе. Такое измерение осуществляют с помощью электрохимической ячейки, представляющей собой сосуд с исследуемым раствором, в который помещены электроды. Электрохимические процессы в растворе сопровождаются появлением или изменением разности потенциалов между электродами или изменением величины тока, проходящего через раствор.
Электрохимические методы классифицируют в зависимости от типа явлений, замеряемых в процессе анализа. В общем случае различают две группы электрохимических методов:
1. Методы без наложения постороннего потенциала, основанные на измерении разности потенциалов, который возникает в электрохимической ячейке, состоящей из электродов и сосуда с исследуемым раствором. Эту группу методов называют потенциометрическими. В потенциометрических методах используют зависимость равновесного потенциала электродов от концентрации ионов, участвующих в электрохимической реакции на электродах.
2. Методы с наложением постороннего потенциала, основанные на измерении: а) электрической проводимости растворов – кондуктометрия; б) количества электричества, прошедшего через раствор, – кулонометрия; в) зависимости величины тока от приложенного потенциала – вольт-амперометрия; г) времени, необходимого для прохождения электрохимической реакции, – хроноэлектрохимические методы (хроновольтамперометрия, хронокондуктометрия). В методах этой группы на электроды электрохимической ячейки налагают посторонний потенциал.
Основным элементом приборов для электрохимического анализа является электрохимическая ячейка. В методах без наложения постороннего потенциала она представляет собой гальванический элемент, в котором вследствие протекания химических окислительно-восстановительных реакций возникает электрический ток. В ячейке типа гальванического элемента в контакте с анализируемым раствором находятся два электрода – индикаторный электрод, потенциал которого зависит от концентрации вещества, и электрод с постоянным потенциалом – электрод сравнения, относительно которого измеряют потенциал индикаторного электрода. Измерение разности потенциалов производят специальными приборами потенциометрами.
В методах с наложением постороннего потенциала применяют электролитическую ячейку, названную так потому, что на электродах ячейки под действием наложенного потенциала происходит электролиз – окисление или восстановление веществ. В кондуктометрическом анализе используют кондуктометрическую ячейку, в которой замеряют электрическую проводимость раствора. По способу применения электрохимические методы можно классифицировать на прямые, в которых концентрацию веществ измеряют по показанию прибора, и электрохимическое титрование, где индикацию точки эквивалентности фиксируют с помощью электрохимических измерений. В соответствии с этой классификацией различают потенциометрию и потенциометрическое титрование, кондуктометрию и кондуктометрическое титрование и т. д.
Приборы для электрохимических определений кроме электрохимической ячейки, мешалки, нагрузочного сопротивления включают устройства для измерения разности потенциалов, тока, сопротивления раствора, количества электричества. Эти измерения могут осуществляться стрелочными приборами (вольтметр или микроамперметр), осциллографами, автоматическими самопишущими потенциометрами. Если электрический сигнал от ячейки очень слабый, его усиливают с помощью радиотехнических усилителей. В приборах методов с наложением постороннего потенциала важной частью являются устройства для подачи на ячейку соответствующего потенциала стабилизированного постоянного или переменного тока (зависит от типа метода). Блок электропитания приборов электрохимического анализа включает обычно выпрямитель и стабилизатор напряжения, который обеспечивает постоянство работы прибора.
Потенциометрия основана на измерении разности электрических потенциалов, возникающей между разнородными электродами, опущенными в раствор с определяемым веществом. Электрический потенциал возникает на электродах при прохождении на них окислительно-восстановительной (электрохимической) реакции. Окислительно-восстановительные реакции протекают между окислителем и восстановителем с образованием окислительно-восстановительных пар, потенциал Е которых определяется по уравнению Нернста, исходя из концентраций компонентов пар [ок] и [вос]:
 . (18)
. (18)
Потенциометрические измерения проводят, опуская в раствор два электрода – индикаторный, реагирующий на концентрацию определяемых ионов, и стандартный электрод или электрод сравнения, относительно которого измеряется потенциал индикаторного. Применяют несколько видов индикаторных и стандартных электродов.
Электроды первого рода обратимы относительно ионов металла, из которого состоит электрод. При опускании такого электрода в раствор, содержащий катионы металла, образуется электродная пара Мn+/М, потенциал которой определяется по уравнению (18). Например, медный электрод, опущенный в раствор соли меди Сu2+, составляет электродную пару Сu2+/Сu, потенциал которой зависит от концентрации Сu2+:
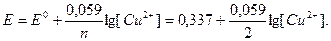
Электроды второго рода чувствительны к анионам и представляют собой металл М, покрытый слоем нерастворимой его соли МА с анионом А-, к которому чувствителен электрод. При контакте такого электрода с раствором, содержащим указанный анион А-, возникает потенциал Е, величина которого зависит от произведения растворимости соли ПРма и концентрации аниона [А-] в растворе:
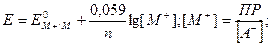
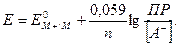 (19)
(19)
Электродами второго рода являются хлорсеребряный и каломельный.
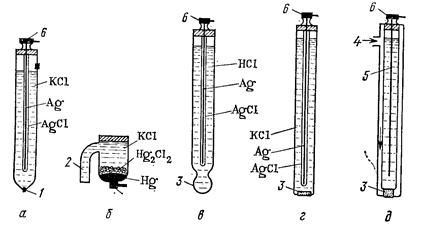
Рисунок 13 – Электроды для электрохимических измерений:
1 – фитиль; 2 – электролитический мост; 3 – мембрана; 4 - ввод органической фазы; 5 – внутренний электрод; 6 – клемма для присоединения электрода к прибору
Хлорсеребряный электрод (рисунок13, а) состоит из стеклянной трубки, в которой находится серебряная проволока, покрытая слоем AgCl и опущенная в раствор KCl (Ag|AgCl|KCl). Контакт электрода с раствором осуществляется через мостик из асбестовой нити, смоченной раствором KCl, с потенциометром – через серебряную проволоку. Потенциал хлорсеребряного электрода зависит от концентрации КСl в растворе. В 1 н. КСl Е=0,220 В, в насыщенном растворе КСl Е=0,199 В по отношению к нормальному водородному электроду.
Каломельный электрод (рисунок 13, б) представляет собой стеклянный сосуд, на дно которого налита ртуть, поверх ртути находится паста из каломели Hg2Cl2 и налит раствор КСl (Hg|Hg2Cl2|KCl). В ртуть опущена платиновая проволока для контакта с прибором, раствор КСl сообщается с анализируемым раствором с помощью электролитического мостика – трубки, заполненной раствором КСl с добавкой агар-агара. Потенциал каломельного электрода Е в 1 н. КСl равен +0,281 В, в насыщенном Е =+0,244 В. Насыщенные хлорсеребряный и каломельный электроды поддерживают постоянный потенциал и применяются в качестве электродов сравнения, по отношению к которым измеряется потенциал индикаторного электрода.
Инертные электроды – пластина или проволока, изготовленная из трудноокисляемых металлов – платины, золота, палладия. Применяются они для измерения Е в растворах, содержащих окислительно-восстановительную пару (например, Fe3+|Fe2+; Се4+|Се3+; MnO4- , H/Mn2+, H2O и др.). Потенциал такого электрода, не принимающего непосредственного участия в электрохимической реакции, определяется соотношением концентраций окисленной и восстановленной форм по уравнению Нернста.
, H/Mn2+, H2O и др.). Потенциал такого электрода, не принимающего непосредственного участия в электрохимической реакции, определяется соотношением концентраций окисленной и восстановленной форм по уравнению Нернста.
Мембранные электроды (см. рисунок 13, в, г, д) различного типа имеют мембрану, на которой возникает мембранный потенциал Е. Величина Е зависит от разности концентраций одного и того же иона по разные стороны мембраны. Простейшим и наиболее употребительным мембранным электродом является стеклянный электрод.
Теория стеклянного электрода была разработана советским ученым акад. Б. П. Никольским. Стеклянный электрод состоит из хлорсеребряного электрода, помещенного в стеклянную трубку с шариком из специального стекла и залитого 0,1 н. НCl. Толщина стенок шарика 0,006…0,1 мм. Ионы щелочных металлов стекла способны обмениваться на Н+ – ионы, которые адсорбируются на тонкой стеклянной стенке (мембране) электрода. Если стеклянный электрод поместить в раствор с значением рН, отличающимся от рН Раствора внутри электрода, то на стеклянной мембране 1 возникает мембранный потенциал. Изменения концентрации Н+– ионов, принимающих участие в ионном обмене с наружной поверхности стеклянной мембраны, приводят к изменению количества адсорбированных Н+ – ионов. При этом наружная гидратированная поверхность стекла приобретает заряд, отличающийся по величине от заряда на внутренней стороне мембраны. Стеклянный электрод в паре с электродом сравнения (обычно применяют насыщенный хлорсеребряный электрод), опущенный в анализируемый раствор, образует электрохимическую ячейку. В этой ячейке стекло является электролитическим мостом с большим сопротивлением. Величина ЭДС такой ячейке определяется соотношением активностей 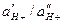 по обе стороны мембраны и при постоянстве
по обе стороны мембраны и при постоянстве 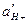 внутри стеклянного электрода зависит от
внутри стеклянного электрода зависит от 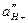 в анализируемом растворе:
в анализируемом растворе:
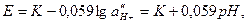 (20)
(20)
где К – постоянная, связанная с неоднородностью (асимметрией) стеклянной мембраны и неравенством потенциалов внутреннего хлорсеребряного электрода и электрода сравнения. Стеклянные электроды, таким образом, чувствительны к изменениям рН среды и широко применяются для его измерения. Стеклянный электрод является в некоторой степени избирательным по отношению к Н+ и позволяет их определять практически в присутствии любых других ионов. Стеклянные электроды хранят в воде или в растворе HCl. Высыхание нарушает стабильную работу электрода и требует предварительного длительного (сутки) замачивания. Идеи, развитые в процессе создания стеклянного электрода, легли в основу разработки мембранных ион-селективных электродов (рисунок 13, г), чувствительных к изменениям концентрации какого-либо одного иона. Ион-селективные электроды могут включать мембраны разных типов. Специальные сорта стекол, способные к ионному обмену на ионы Na+, K+, Li+, позволили создать соответствующие электроды, чувствительные только к одному из указанных ионов. При прессовании порошков некоторых солей (CuS, PbS, Ag2S) получены ион-селективные электроды на F-, S2- и др. Смешивание нерастворимых солей типа AgBr, AgCl, AgI и других с некоторыми пластмассами (каучуки, полиэтилен, полистирол) привело к созданию ион-селективных электродов на Br-, Сl-, I-.
Идеи, развитые в процессе создания стеклянного электрода, легли в основу разработки мембранных ион-селективных электродов (рисунок 13, г), чувствительных к изменениям концентрации какого-либо одного иона. Ион-селективные электроды могут включать мембраны разных типов. Специальные сорта стекол, способные к ионному обмену на ионы Na+, K+, Li+, позволили создать соответствующие электроды, чувствительные только к одному из указанных ионов. При прессовании порошков некоторых солей (CuS, PbS, Ag2S) получены ион-селективные электроды на F-, S2- и др. Смешивание нерастворимых солей типа AgBr, AgCl, AgI и других с некоторыми пластмассами (каучуки, полиэтилен, полистирол) привело к созданию ион-селективных электродов на Br-, Сl-, I-.
Получают распространение электроды с жидкой мембраной (рисунок 13, д), представляющей собой пористую пластинку, пропитанную жидкостью, не смешивающейся с водой и способной к избирательной адсорбции определенных ионов (например, растворы хелатов Ni2+, Cd2+, Fe2+ в органическом растворителе). Для проведения потенциометрических определений собирают электрохимическую ячейку из индикаторного электрода и электрода сравнения, которые опускают в анализируемый раствор и подсоединяют к потенциометру. Применяемые в потенциометрии электроды имеют большое внутреннее сопротивление (500…1000 МОм), поэтому существующие типы потенциометров представляют собой сложные электронные высокоомные вольтметры.
Потенциометрическое титрование проводят в тех случаях, когда химические индикаторы использовать нельзя или при отсутствии подходящего индикатора.
В потенциометрическом титровании в качестве индикатора используют электроды потенциометра, опущенные в титруемый раствор. При этом применяют электроды, чувствительные к титруемым ионам. В процессе титрования изменяется концентрация ионов, что регистрируется на шкале измерительного прибора потенциометра. Записав показания потенциометра в единицах рН или мВ, строят график их зависимости от объема титранта (кривую титрования), определяют точку эквивалентности и объем титранта, израсходованный на титрование.
В простейшем случае для потенциометрического титрования собирают установку, состоящую из стакана, магнитной мешалки, рабочего электрода, электрода сравнения, бюретки и потенциометра (рис.14). Электрод сравнения соединяют с титруемым раствором через электролитический мост. В стакан отмеривают определенный объем титруемого раствора и порциями добавляют титрант. Предварительно проводят пробное титрование для ориентировочного определения точки эквивалентности. После добавления каждого кубического метра титранта записывают показания прибора либо в единицах рН, либо в милливольтах (мВ). Возле точки эквивалентности для большей точности титрант добавляют по каплям. После точки эквивалентности титрование продолжают, добавляя еще некоторый о6ъем титранта. По полученным данным строят кривую потенциометрического титрования.
Кривая потенциометрического титрования имеет вид, аналогичный кривой титрования в титриметрическом анализе (рисунок 15, а). По кривой титрования определяют точку эквивалентности, которая находится в середине скачка титрования. Для этого проводят касательные к участкам кривой титрования и по середине касательной скачка титрования определяют точку эквивалентности; Для большей точности определения точки эквивалентности применяют дифференциальные кривые титрования (рисунок 15, б), которые строят по вычисленным значениям 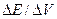 или
или 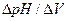 . Величины
. Величины 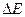 или
или 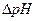 определяют как разность между показаниями прибора после добавления каждой порции титранта
определяют как разность между показаниями прибора после добавления каждой порции титранта 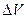 .Наибольшее значение
.Наибольшее значение 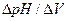 приобретает в точке эквивалентности. Дифференциальный способ построения кривых титрования позволяет достаточно четко (в пределах 0,05…0,1 см3) выделить точку эквивалентности. Эту особенность дифференциальных кривых можно применить при титровании слабых кислот и оснований и их смесей.
приобретает в точке эквивалентности. Дифференциальный способ построения кривых титрования позволяет достаточно четко (в пределах 0,05…0,1 см3) выделить точку эквивалентности. Эту особенность дифференциальных кривых можно применить при титровании слабых кислот и оснований и их смесей.
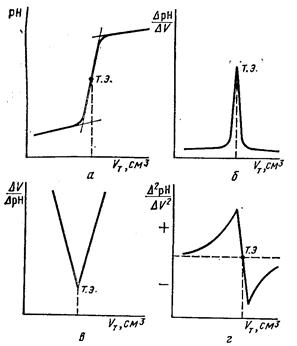
Рисунок 15 – Кривые потенциометрического титрования
|
|
Дата добавления: 2014-01-07; Просмотров: 1324; Нарушение авторских прав?; Мы поможем в написании вашей работы!