
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кондуктометрия. Кондуктометрическое титрование
|
|
|
|
Кондуктометрия основана на измерении электрической проводимости растворов. Если в раствор вещества поместить два электрода (платиновых или других инертных) и подать на электроды разность потенциалов, то через раствор потечет электрический ток. Как и каждый проводник электричества, растворы характеризуются сопротивлением R и обратной ему величиной – электрической проводимостью L (см-). Сопротивление раствора R (Ом) прямо пропорционально расстоянию между электродами l, удельному сопротивлению раствора 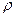 и обратно пропорционально площади электродов S:
и обратно пропорционально площади электродов S:
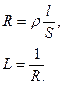 (21)
(21)
Удельное сопротивление 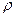 является характеристикой раствора как проводника и представляет собой сопротивление раствора при l и S, равных единице. Величина, обратная удельному сопротивлению, называется удельной электрической проводимостью
является характеристикой раствора как проводника и представляет собой сопротивление раствора при l и S, равных единице. Величина, обратная удельному сопротивлению, называется удельной электрической проводимостью  :
:
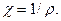 (22)
(22)
Растворы индивидуальных веществ характеризуются эквивалентной электрической проводимостью 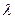 , представляющей собой электрическую проводимость объема раствора, содержащего 1 моль вещества:
, представляющей собой электрическую проводимость объема раствора, содержащего 1 моль вещества:

где С – концентрация вещества, моль/дм3.
Электрическая проводимость раствора при кондуктометрических измерениях определяется его концентрацией С, подвижностью ионов U и постоянной (константой) ячейки К, учитывающей размер электродов, расстояние между ними, объем раствора в ячейке, её форму и т. д.:
L = KCU. (23)
Зависимость (25) лежит в основе кондуктометрического анализа.
 Чаще применяют кондуктометрическое титрование. При кондуктометрическом титровании в ячейку с электродами помещают анализируемый раствор, ячейку помещают на магнитную мешалку и титруют соответствующим титрантом. Титрант добавляют равными порциями. После добавления каждой порции титранта замеряют электрическую проводимость раствора и строят график зависимости между электрической проводимостью и объемом титранта (рисунок 16). Различные ионы в растворах имеют отличающиеся друг от друга подвижности. Наиболее высокой подвижностью обладают Н+ (319,8) и ОН- (198,3От подвижности ионов зависит электрическая проводимость раствора: чем выше подвижность ионов, тем больше электрическая проводимость раствора.
Чаще применяют кондуктометрическое титрование. При кондуктометрическом титровании в ячейку с электродами помещают анализируемый раствор, ячейку помещают на магнитную мешалку и титруют соответствующим титрантом. Титрант добавляют равными порциями. После добавления каждой порции титранта замеряют электрическую проводимость раствора и строят график зависимости между электрической проводимостью и объемом титранта (рисунок 16). Различные ионы в растворах имеют отличающиеся друг от друга подвижности. Наиболее высокой подвижностью обладают Н+ (319,8) и ОН- (198,3От подвижности ионов зависит электрическая проводимость раствора: чем выше подвижность ионов, тем больше электрическая проводимость раствора.
Рисунок 16 – Кривые кондуктометрического титрования
Характер кривых кондуктометрического титрования различеные зависимости от величины подвижности ионов определяемого вещества и титранта. Рассмотрим основные типы кривых кондуктометрического титрования.
Титруемое вещество и титрант имеют ионы с высокой подвижностью. При титровании, например, НСl раствором NaOH (рисунок 16, а) в растворе сначала присутствуют Н+ – ионы, имеющие высокую подвижность, по мере титрования их концентрация уменьшается и электрическая проводимость раствора падает. В точке эквивалентности электрическая проводимость раствора минимальна. При добавлении избытка NaOH в растворе появляются свободные ОН+ – ионы, имеющие высокую подвижность, и электрическая проводимость раствора снова возрастает. Восходящий участок кривой титрования имеет меньший угол наклона вследствие более низкой подвижности ионов ОН-.
Титруемое вещество и титрант имеют ионы с низкой подвижностью. Например, при титровании Na2SO4 раствором ВаСl2 электрическая проводимость раствора до точки эквивалентности практически неизменна (рисунок 16, б), так как малоподвижные SO42- -ионы связываются в сульфат бария и заменяются Сl- – ионами с близкой подвижностью, количество Na+ остается неизменным. После точки эквивалентности вследствие появления избытка Ba2+– и Сl- – ионов электрическая проводимость раствора возрастает.
Титруемое вещество имеет ионы с высокой подвижностью, титрант – с низкой. В этом случае до точки эквивалентности электрическая проводимость раствора снижается, после точки эквивалентности – изменяется незначительно (рисунок 20, в). Примером здесь может служить титрование НСl раствором NaHCO3.
Титруемое вещество имеет ионы с низкой подвижностью, титрант – с высокой. Например, при титровании СаСl2 раствором NaOH электрическая проводимость раствора сначала несколько уменьшается вследствие замены ионов Са2+, связываемых в осадок Са(ОН)2 на Na+, затем возрастает при появлении избытка ОН –ионов (рисунок 16, г). Кривые кондуктометрического титрования могут искажаться вследствие гидролиза и других причин.
Кондуктометрическое титрование обладает рядом преимуществ. Его можно проводить в мутных и окрашенных средах, в отсутствие химических индикаторов. Метод обладает повышенной чувствительностью и позволяет анализировать разбавленные растворы веществ (до 10-4 моль/дм3). Кондуктометрическим титрованием анализируют смеси веществ, так как различия в подвижности различных ионов существенны и их можно дифференцирование оттитровывать в присутствии друг друга. Точность кондуктеметрического титрования находится в пределах точности титриметрического анализа.
Кондуктометрический анализ легко автоматизировать, если раствор титранта подавать из бюретки с постоянной скоростью, а изменения электрической проводимости раствора регистрировать на самописце. Эта разновидность кондуктометрии получила название хронокондуктометрического анализа, так как по времени титрования до точек перегиба кривой титрования можно рассчитать результат.
В кондуктометрии используют практически все аналитические реакции, и диапазон определяемых веществ здесь необычайно широк.
В кислотно-основном титровании кондуктометрическим путем можно определять сильные кислоты, слабые кислоты (имеющие значения рK до 8…10), смеси сильных и слабых кислот (с  > 4), соли слабых оснований и сильных кислот. Кислотно-основные методы кондуктометрического титрования основаны на высокой подвижности ионов Н+ и ОН-, малейшие изменения концентрации которых приводят к значительным изменениям электрической проводимости растворов. В качестве титрантов в кислотно-основном кондуктометрическом титровании применяют 0,1 н., 0,01 н., 0,001 н. растворы HCl, NaOH, титруют растворы, содержащие от 0,1 до 0,001 моль/дм3 определяемых веществ.
> 4), соли слабых оснований и сильных кислот. Кислотно-основные методы кондуктометрического титрования основаны на высокой подвижности ионов Н+ и ОН-, малейшие изменения концентрации которых приводят к значительным изменениям электрической проводимости растворов. В качестве титрантов в кислотно-основном кондуктометрическом титровании применяют 0,1 н., 0,01 н., 0,001 н. растворы HCl, NaOH, титруют растворы, содержащие от 0,1 до 0,001 моль/дм3 определяемых веществ.
В осадительном кондуктометрическом титровании электрическая проводимость титруемых растворов сначала уменьшается или остается на некотором постоянном уровне вследствие связывания титруемого электролита в осадок, после точки эквивалентности при появлении избытка титранта – снова возрастает.
В комплексонометрическом кондуктометрическом титровании изменения электрической проводимости раствора наступают вследствие связывания катионов металла в комплекс с ЭДТА (или другими лигандами). При этом для каждого катиона с помощью буферных растворов регулируют рН среды, влияющий на характер кривых титрования. Титрованию подвергают 0,01 0,005 М растворы солей металлов. Комплексонометрическим путем можно определять Cu2+, Ni2+, Zn2+, Co2+, Cd2+, А13+, Са2+ и др.
0,005 М растворы солей металлов. Комплексонометрическим путем можно определять Cu2+, Ni2+, Zn2+, Co2+, Cd2+, А13+, Са2+ и др.
Окислительно-восстановительное кондуктометрическое титрование основано на изменении концентрации реагирующих ионов и появлении в растворе новых ионов, что изменяет электрическую проводимость раствора. Например, при титровании арсенитов раствором иода в присутствии гидрокарбоната натрия из раствора исчезает АsО33- и появляются АsО43- и I-. До точки эквивалентности электрическая проводимость раствора возрастает, после точки эквивалентности изменяется мало.
К недостаткам метода следует отнести малую селективность.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 5405; Нарушение авторских прав?; Мы поможем в написании вашей работы!