
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Извлечение урана из растворов (пульп) с применением ионного обмена
|
|
|
|
Ионный обмен. Общие положения
Выделение урана из растворов (пульп) с применением ионного обмена
Ионообменные процессы занимают важное место в атомной технологии. Кроме указанного применения для извлечения урана из растворов (пульп), получаемых при выщелачивании урановых руд, ионообменные процессы используются для полного обессоливания воды на АЭС, для улавливания радиоактивных изотопов из сточных вод атомных предприятий.
В силу большой важности ионообменных процессов в атомной промышленности остановимся на общих положениях ионного обмена.
Ионный обмен - процесс, при котором происходит стехиометрический обмен ионов одного знака между ионитом и раствором.
Иониты - твердые высокомолекулярные вещества, способные поглощать из раствора электролита положительные или отрицательные ионы в обмен на эквивалентное количество других ионов того же знака. Они имеют трехмерную пространственную структуру макромолекул. Этим объясняется их низкая растворимость.
По знаку заряда обменивающихся ионов иониты разделяются на катиониты и аниониты.
Каждый ионит состоит из каркаса (матрицы), связанного валентными силами или силами кристаллической решетки. В матрице закреплены фиксированные ионы, которые создают на ней положительный или отрицательный заряд, компенсирующийся зарядом подвижных ионов противоположного знака (противоионов). Противоионы свободно перемещаются в порах ионита и могут быть заменены другими противоионами.
Катионит представляет полианион с подвижными катионами, а анионит - поликатион с подвижными анионами.
Существуют также биполярные иониты (амфолиты), имеющие и катионо- и анионообменные группы.
|
|
|
Для наглядности ионит можно сравнить с губкой, на нитях которой в отдельных точках имеется избыточный электрический заряд (фиксированные ионы), в порах губки циркулируют противоионы. Если губка погружается в раствор, подвижные противоионы могут ее покинуть и перейти в раствор. Для сохранения электронейтральности в губку обязательно должно войти эквивалентное число других ионов того же знака.
При ионообменном извлечении урана из полученных при выщелачивании растворов (пульп) ставится задача сконцентрировать уран и освободиться при этом от большей части примесей.
Извлечение урана из сернокислых растворов (пульп) с применением катионитов. Как уже отмечалось, уран в сернокислых растворах может находиться в виде катиона уранила, недиссоциированной молекулы уранилсульфата и в виде сульфатных комплексных анионов, соотношение между которыми зависит от концентрации сульфат-ионов и иона уранила в соответствии с реакциями:
UO22+ + SО4 2- = UО2SО4, K1 = 50,
UO22+ + 2SО42- = [UО2(SО4)2]2-, K2 = 350,
UO22+ + 3SО42- = [UО2(SО4)3]4-, К3 = 2500.
Можно считать, что в растворе существует подвижное равновесие:
UO22+ + SO42- = UО2SО4 + SO42- = [UО2SО4]22- + SO2- = [UО2(SО4)3]4-.
Следовательно, для извлечения урана можно применить и катиониты, которые будут извлекать катион уранила, и аниониты, которые будут извлекать сульфатные анионные комплексы, главным образом [UО2(SО4)3]4-.
По мере удаления ионов UО22+ или [UО2(SО4)3]4- из растворов в ионит будет наблюдаться сдвиг равновесия в растворе в сторону извлекаемого иона.
Сильнокислотные катиониты (например, КУ-2) не могут быть применены для извлечения урана из растворов после выщелачивания. При увеличении концентрации сульфат-иона до 10 - 15 г/л емкость резко уменьшается (вплоть до нуля). Это связано с тем, что по мере увеличения концентрации сульфат-иона подвижное равновесие сдвигается в сторону образования сульфатных анионных комплексов и коэффициент активности катиона уранила во внешнем растворе уменьшается.
|
|
|
В этих условиях может работать слабокислотный катионит СГ-1. В данном случае уменьшение коэффициента активности иона уранила в растворе компенсируется уменьшением коэффициента активности иона уранила в фазе ионита. Известно, что растворимость солей уранила и карбоновых кислот мала (например, для оксалата уранила).
Процесс извлечения урана смолой СГ-1 описывается уравнением
2R-СООН + UO22+ = (RCOO)2UO2 + 2Н+.
В соответствии с этим уравнением повышение кислотности сдвигает равновесие влево, поэтому при малых значениях рН (менее 1) емкость по урану равна 0. При увеличении рН выше 1,2 емкость начинает расти и достигает максимума при рН = З - 5, затем несколько уменьшается.
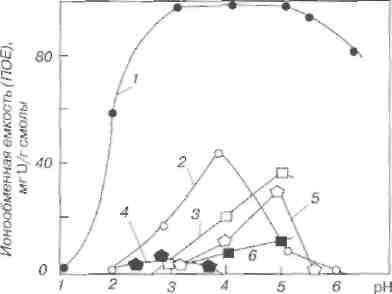
Влияние рН на емкость смолы СГ-1 по урану и примесям (концентрация урана в растворе 1 г/л):
1 UO22+; 2 - А13+; 3 - Мn2+; 4 - Fe3+; 5 – Fe2+; 6 – Cu2+.
Рабочей областью считается рН 2,8 - 3,5, при меньших значениях рН уменьшается емкость, при больших значениях рН следует считаться с опасностью осаждения урана вследствие гидролиза (гидролиз сульфата уранила начинается при рН = 3,8).
Так как в процессе ионного обмена выделяется кислота (Н+) и рН уменьшается, то во время «сорбции» для поддержания заданного значения рН добавляют щелочные реагенты: NH4OH, NaOH или известковое молоко.
Двухзарядные катионы примесей (Fe2+ и Мn2+) не могут конкурировать с уранилом (его преимущества - меньший размер гидратной оболочки и малый коэффициент активности в ионите). При рН 3 емкость по иону Mn2+ при концентрации его в растворе 5 г/л составляет 4 мг/г, или 0,14 мг-экв/г, емкость по Fe2+ (концентрация в растворе 2 г/л) - 2 мг/г, или 0,07 мг-экв/г. По тем же причинам двухзарядный катион уранила «сорбируется» смолой СГ-1 лучше, чем трехзарядный катион алюминия. Емкость по Al3+ (при концентрации в растворе 2 г/л) составляет 20 мг/г, или 2,2 мг-экв/г; емкость по урану 100 мг/г, или 0,8 мг-экв/г, что в 2,6 раза меньше, чем А13+. Но концентрация алюминия в растворе 2 г/л, или 0,22 н., в то время как концентрация урана 1 г/л, или ~ 0,01 н., т. е. в 20 раз меньше, чем у А1. С уранилом мог бы конкурировать ион Fe3+. Но нужно учесть, что гидролиз сульфата трехвалентного железа начинается при рН = 2,5,
Наличие комплексообразующих ионов (F-, С2O42-, РО43-) может привести к снижению емкости СГ-1 по урану, поскольку уменьшается активность иона уранила. Присутствие нитрат-иона не влияет на емкость по урану. После насыщения смолы и отделения ее от раствора (пульпы) проводится регенерация смолы (так называемая десорбция). Как следует из приведенного выше графика, регенерацию можно провести любой кислотой при рН < 1. Поэтому для регенерации используется 2 - 5%-ный раствор серной, азотной или соляной кислоты, причем с увеличением концентрации кислоты уменьшается объем товарного регенерата. При регенерации примерно 90 % урана извлекается в объем регенерата, соответствующий объему смолы, а окончание регенерации наблюдается при пропускании через смолу 4 - 5 объемов регенерирующего раствора (элюата). При удельном объеме набухшей смолы СГ-1 2,0 - 2,5 мл/г объемная емкость составит 40 - 50 г урана на 1 л смолы, значит, при объеме регенерата 4 л концентрация урана в нем будет 10 - 12 г/л.
|
|
|
Таким образом, при проведении цикла «сорбция-десорбция» происходит концентрирование урана в десятки раз и освобождение от большей части примесей. В солевой части товарного регенерата содержание урана составляет 50 - 70 % (в пересчете на U308).
Извлечение урана из сернокислых растворов (пульп) с применением анионитов. Как было указано, в сернокислом растворе существует подвижное равновесие между различными формами урана от катиона уранила до четырехзарядного сульфатного анионного комплекса. Соотношение между этими комплексами зависит от концентрации сульфат-иона и кислотности.
При рН < 1 уран почти полностью находится в виде комплексного аниона [UО2(SО4)3]4-
В этом случае «сорбция» урана идет следующим образом:
2 (R4N)Cl + [UO2(SO4)3]4- = (R4N)4[UO2(SO4)3] + 4Cl-
При высокой кислотности наряду с ураном «сорбируются» и ионы бисульфата (HSO4)-, обладающие довольно большим сродством к сильноосновным смолам. В силу этого при повышении кислотности емкость анионитов по отношению к урану уменьшается; особенно резко это сказывается у сильноосновных смол.
При увеличении рН в пределах 1,5-5 концентрация анионных комплексов уменьшается и увеличивается концентрация недиссоциированных молекул уранил сульфата и катиона уранила. Наиболее вероятный механизм «сорбции» урана можно представить следующим образом: вначале происходит переход смолы от хлоридной или нитратной формы в сульфатную форму, а затем к ней присоединяются молекула уранилсульфата или ионы уранила и сульфата:
|
|
|
2 (R4N)Cl + SO42-= (R4N)2SO4 + 2 Сl-,
2 (R4N)2SO4 + UO2+ + SO42- = (R4N)4[UO2(SO4)3].

 Если сложить эти реакции, то получим
Если сложить эти реакции, то получим
4 (R4N)C1 + UO22+ + 3 SO42- = (R4N)4[UO2(SO4)3] + 4Сl-.
При рН > 2,5 общее поглощение урана на сильноосновных смолах (полная емкость 3-3,5 мг-экв/г) может быть выше, чем это соответствует полному насыщению смолы анионами [UO2(SO4)3]4- и HSO4-. По всей вероятности, это обусловлено частичным гидролизом иона уранила:
2 UO22++ 2 OH- = U2O52+ + H2O,
и «сорбцией» на смоле наряду с [UO2(SO4)3]4-- и иона [U2O5(SO4)3]4-. Поскольку среда - кислая (рН < 4), то в ней могут работать аниониты любой основности, даже слабоосновные и очень слабоосновные. Поэтому для извлечения урана из сернокислых растворов можно использовать и слабоосновный анионит АН-2Ф, получаемый при поликонденсации производных фенола и полиэтиленполиамина. Он обладает высокой селективностью и емкостью при поглощении урана из растворов с большой избыточной кислотностью. Среднеосновный анионит ЭДЭ-10П (продукт поликонденсации полиэтиленполиамина и эпихлоргидрина) обладает высокой емкостью по урану при извлечении его из фосфорнокислых растворов. Широко используются сильноосновные аниониты гелевой структуры (дауэкс-1, IRA-400, AM, АМП, ВП-1А, ВП-ЗА), макропористые аниониты (АМ-п, АМП-п, ВП-1Ап, Россион-1п, Purolite A-500/2788), бифункциональный макропористый анионит АМ-2Б, среднеосновные аниониты АМ-3, ВП-1п и др. Все они - полимеризационные смолы, их преимущества перед поликонденсационными смолами заключаются в лучшей химической и механической стойкости, большей скорости диффузии. Поэтому они используются шире, чем поликонденсационные смолы. Из зависимостей емкости ряда смол от кислотности среды следует, что смолы АН-2Ф и ЭДЭ-10П особенно хороши при большой кислотности, где емкость сильноосновных смол мала (25-50 мг/г). При использовании сильноосновных смол лучше проводить «сорбцию» урана при рН = 2 - 3, т. е. в этом случае нужно перед «сорбцией» проводить частичную нейтрализацию раствора (пульпы) раствором аммиака, едкого натра или известковым молоком.
Аниониты проявляют большую селективность по отношению к урану, чем катиониты. Это связано с двумя обстоятельствами: во-первых, аниониты «сорбируют» уран в виде четырехзарядного анионного комплекса, в то время как заряд катиона уранила (+2); во-вторых, большая часть примесей находится в катионной форме, не давая анионных комплексов и, следовательно, не участвуя в обмене.
Вместе с ураном могут «сорбироваться» молибден в виде сульфатного анионного комплекса [MoO2(SO4)3]4-, а также в небольших количествах железо в виде [Fe(SO4)2]-, [Fe(SO4)3]3-, [Fe(OH)(SO4)2]2-, фосфат-ион, ванадат-ион. Присутствие молибдена, ванадата, фосфата, цианида снижает емкость по урану.
После насыщения смолы проводится ее регенерация («десорбция») путем вытеснения анионных комплексов ионами Сl- или NO3- при повышении их концентрации. В качестве вымывающих растворов используют 1 моль/л NaCl, подкисленный 0,1 моль/л НС1 или 1 моль/л NH4N03, подкисленный 0,1 моль/л HN03 или 0,15 моль/л H2S04.
Если регенерацию ионита проводить в динамических условиях, пропуская регенерирующий раствор через неподвижный слой насыщенного ионита, то кривая вымывания имеет вид, показанный на рисунке.
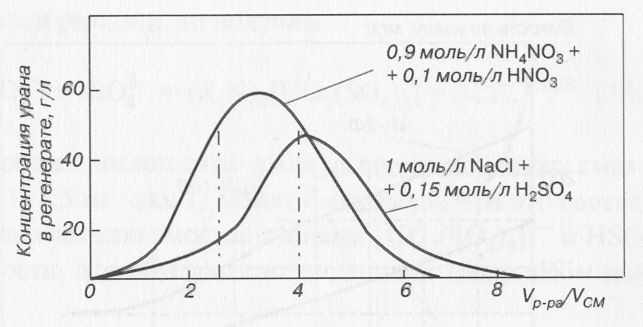
Зависимость концентрации урана в товарном регенерате от соотношения объемов регенерата и смолы.
Первый и второй объемы содержат несколько процентов урана и основное количество железа, эти объемы можно возвратить на «сорбцию». Объемы 3, 4 и 5 содержат основное количество урана - это товарный регенерат с высокой концентрацией урана; объемы 6, 7 и 8 с небольшим содержанием урана можно использовать на приготовление регенерирующего раствора.
Если же «десорбция» проводится в противоточном каскаде, то концентрация урана в товарном регенерате усредняется, т. е. может составить 10-20 г/л. Из таких растворов путем щелочного осаждения можно получить концентрат урана с содержанием 70-90 % U308, фильтраты можно повторно использовать для приготовления «десорбирующего» раствора.
Один из вариантов организации технологического процесса «сорбции-десорбции» приведен на рисунке.
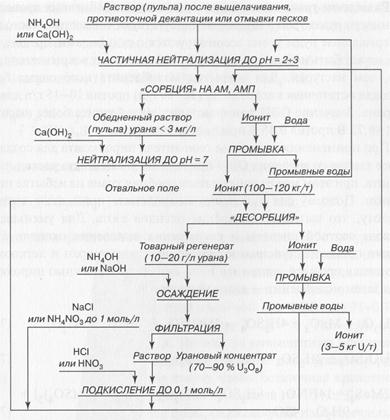
Технологическая схема анионообменного извлечения урана из сернокислых растворов (пульп).
При длительной работе ионита наблюдается некоторое уменьшение емкости смолы за счет постепенного накопления примесей, не снимаемых со смолы растворами солей и кислот. Наступает «отравление» смолы. Приходится периодически удалять такие примеси путем специальной обработки. Например, ванадат-ион отмывается раствором сернистой кислоты (H2SO3), которая восстанавливает ванадий до четырехвалентного состояния, в котором ванадий проявляет только основные свойства, а катион VO2+ не дает анионных комплексов. Молибдат-ион (МоO4)2- отмывается только крепким раствором щелочи.
Нужно отметить, что в сильнокислой среде (рН < 2) ванадий и молибден находятся в форме катионов ванадила (VO2+) и молибденила (МоO2)2+, поэтому опасность отравления смолы ванадат-ионом (VO3-) и молибдат-ионом (МоO42-) появляется только при более высоких значениях рН (вспомним, что осаждение ванадиевой и молибденовой кислот проводится при рН 2,5).
Очень вредно на процессе ионного обмена сказывается отравление смолы кремниевой кислотой. Так, на одном из заводов за год работы содержание SiO2 в анионите ВП-1Ап достигло 28 % (маcc.), при этом емкость по урану снизилась на 13 %. Для удаления кремнекислоты смола обрабатывалась раствором щелочи (10 - 15 г/л) в присутствии защитной добавки сульфата натрия в течение 3 ч при отношении Т: Ж = 1:3. Затем смола отмывалась от щелочи последовательно 10%-ным раствором Na2SO4 и водой.
В ЮАР комплексный анион [Co(CN)6]4- удаляли раствором роданида аммония или горячим раствором нитрита натрия (NaNO2). Серу со смолы снимали промывкой раствором NaOH, содержащим сульфид натрия .
.
Разделение урана и молибдена с помощью ионообменных процессов
Во многих рудах уран и молибден присутствуют совместно. Часто гидротермальные руды урана ассоциируются с сульфидами, среди которых может быть и молибденит (MoS2). Молибденит вскрывается труднее, чем настуран. Для вскрытия молибденита необходима более высокая остаточная кислотность (30-60 г/л) против 10-15 г/л для настурана. Значение ОВП при окислении молибденита более высокое: 0,71-0,72 В против 0,45 В при окислении урана.
При применении в качестве окислителя пиролюзита для создания более высокого значения ОВП приходится увеличивать расход пиролюзита, при этом может наблюдаться сорбция урана на избытке пиролюзита. Поэтому для окисления молибденита применяют азотную кислоту, что вызывает выделение оксидов азота. Для уменьшения расхода азотной кислоты и сокращения выделения оксидов азота можно провести ступенчатое окисление: сначала уран и легкоокисляющиеся примеси, например Fe2+, окислить с помощью пиролюзита, а затем молибденит - азотной кислотой:
U3O8 + MnO2 + 4 H2SO4 = 3 UO2SO4 + MnSO4 + 4 H2O,
UO2SO4 + 2 H2SO4 = H4[UO2(SO4)3],
2 MoS2 + 14 HNO3 + 6 H2SO4 = 7 N2O3 + 2 H4[MoO2(SO4)3] + 9 H2O + 4 SO2.
При «сорбции» на анионитах (AM, АМП, ВП-1Ап и др.) уран и молибден извлекаются в виде аналогичных сульфатных комплексных анионов:
4 R4NHSO4 + [UO2(SO4)3]4- = (R4N)4[UO2(SO4)3] + 4 HSO4-,
4 R4NHSO4 + [Mo(SO4)3]4- = (R4N)4[MoO2(SO4)3] + 4 HSO4-.
«Десорбцию» урана и молибдена можно провести 15%-ным раствором серной кислоты путем сдвига равновесия данных реакций влево при повышении концентрации иона бисульфата.
Разделение урана и молибдена можно осуществить путем осаждения диураната аммония из товарного регенерата, при этом молибден останется в растворе в виде молибдата аммония. Но такой процесс экономически невыгоден из-за большого расхода аммиака на нейтрализацию серной кислоты. Выгоднее отделить уран от молибдена путем раздельной «десорбции».
Сначала со смолы снимается молибден при обработке ее раствором, содержащим 13 % (NH4)2SO4 и 3-10 % NH4OH:
(R4N)4[MoO2(SO4)3] + 8 NH4OH =
= (NH4)2MoО4 + 3(NH4)2SO4 + 4R4NOH + 2H2О.
Уран впоследствии снимается 15%-ной серной кислотой:
(R4N)4[UO2(SO4)3] + 4HSO4- = 4R4NHSO4 + UO22++ 3SO42-
Один из вариантов технологической схемы переработки уран-молибденовых руд приведен на рисунке.
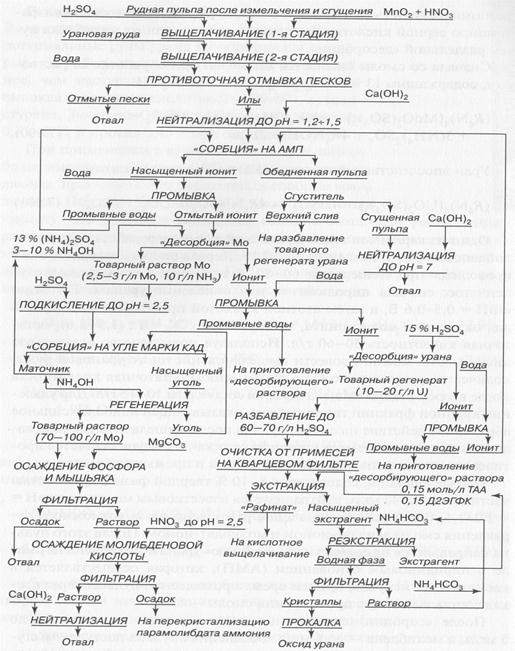
Технологическая схема переработки уран-молибденовых руд.
Первая стадия выщелачивания проводится при температуре 60 - 80 °С в течение 3 ч, окисление ступенчатое: сначала пиролюзитом для окисления урана и Fe при ОВП = 0,5 - 0,6 В, а затем азотной кислотой при ОВП = 0,71 - 0,72 В для окисления молибденита, отношение Т: Ж = 1: (1,5 - 2,0), остаточная кислотность 30-60 г/л. Используя повышенную остаточную кислотность, можно провести выщелачивание чисто урановой руды; количество руды должно быть таким, чтобы остаточная кислотность после второй стадии выщелачивания составляла 10 - 15 г/л. Для удаления крупной фракции твердой фазы, оказывающей наиболее сильное абразивное действие на смолу, пульпа после выщелачивания направляется в каскад из четырех классификаторов, где осуществляется противоточное движение отмываемых песков и промывной воды.
Иловая фракция, содержащая 8 - 10 % твердой фазы с крупностью частиц меньше 43 мкм, нейтрализуется известковым молоком до рН 1,25-1,5, более высокое значение рН опасно из-за возможного отравления смолы ванадат-ионом и молибдат-ионом. После этого пульпа направляется на совместную «сорбцию» урана и молибдена на смоле с пиридиновым основанием (АМП), которая осуществляется в каскаде из 11 пачуков, причем время прохождения пульпы через каскад составляет 10 ч, а прохождения смолы - 80 ч.
После «сорбции» содержание урана в пульпе уменьшается до 5 мг/л, а молибдена - до 6 мг/л. Обедненная пульпа поступает в сгуститель, откуда сгущенная пульпа, содержащая 50 - 60 % твердой фазы, после нейтрализации перекачивается на отвальное поле, а верхний слив может быть использован для разбавления кислого регенерата урана. Насыщенный ионит отмывается водой от пульпы, пульпа и промывные воды возвращаются на «сорбцию». Отмытый ионит, содержащий примерно 55 кг урана и 25 кг молибдена на 1 т смолы, направляется на «десорбцию» молибдена, осуществляемую раствором, содержащим 13 % сульфата аммония и 3 - 10 % раствора аммиака.
«Десорбция» молибдена осуществляется в каскаде из трех колонн непрерывной «сорбции» с пневматической разгрузкой (КНСПР), где обеспечивается противоток смолы и регенерирующего раствора (устройство аппаратов ионообменных процессов рассмотрено ниже). Общее время регенерации - 16 ч, соотношение объемов смолы и регенерирующего раствора - 1: 2,5. Полученный товарный раствор молибдена содержит 2,5 - 3 г/л молибдена и 10 г/л аммиака. Для концентрирования молибдена можно провести его адсорбцию на активированном угле марки КАД после подкисления молибденового раствора до рН 2,5 для образования молибденовой кислоты. После регенерации активированного угля, проводимой раствором аммиака, раствор содержит уже 70 - 100 г/л молибдена. Этот раствор очищается от фосфора и мышьяка путем осаждения фосфата и арсената магния с помощью карбоната магния. Из очищенного раствора осаждается молибденовая кислота, которая растворяется аммиаком, после перекристаллизации получается товарный продукт в виде парамолибдата аммония. Ионит, освобожденный от молибдена, после отмывки от регенерирующего раствора направляется на «десорбцию» урана. Ее можно осуществить 15%-ной серной кислотой. Процесс проводится в противоточном каскаде колонн, общее время регенерации 25 - 30 ч при соотношении объемов смолы и регенерирующего раствора 1:2. Ионит после отмывки от регенерирующего раствора возвращается на совместную «сорбцию» урана и молибдена. Концентрация урана в полученном товарном регенерате составляет 8 - 10 г/л.
Серьезной задачей является использование серной кислоты, содержание которой в товарном регенерате составляет 120 г/л. Регенерат разбавляют верхним сливом сгустителя до концентрации 60-70 г/л H2S04 и после очистки от механических примесей на кварцевом фильтре направляют на экстракционное извлечение урана, которое проводят смешанным экстрагентом: 0,15 моль/л раствор триалкиламина (ТАА) и 0,15 моль/л раствор ди-2-этилгексилфосфорной кислоты (Д2ЭГФК) в «керосине». После экстракции урана «рафи
 нат», содержащий 60-70 г/л H2SO4, может быть использован для кислотного выщелачивания урановой руды.
нат», содержащий 60-70 г/л H2SO4, может быть использован для кислотного выщелачивания урановой руды.
Уран из насыщенного экстрагента извлекается с помощью твердофазной реэкстракции концентрированным раствором карбоната или бикарбоната аммония. Отфильтрованные кристаллы трикарбонатного комплекса уранила и аммония после сушки и прокалки перерабатываются на оксиды урана, а карбонатный раствор возвращается на реэкстракцию. Сернокислотный вариант «десорбции» урана имеет смысл тогда, когда имеется возможность использования «рафината» экстракции для кислотного выщелачивания.
Возможен и более «мягкий» вариант «десорбции» урана с применением растворов карбоната и бикарбоната аммония:
(R4N)4[UO2(SO4)3] + 5 (NH4)2CO3 =
= 2 (R4N)2CO3 + (NH4)4[UO2(CO3)3] + 3 (NH4)2SO4,
(R4N)4[UO2(SO4)3] + 5 NH4HCO3 =
= 2 (R4N)2CO3 + (NH4)4[UО2(CO3)3] + NH4HSO4 + 2 H2SO4.
Преимущество этого варианта заключается в том, что после ионообменных процессов целесообразен карбонатный аффинаж урана.
Перед возвращением ионита в цикл необходимо провести перезарядку смолы в бисульфатную форму путем обработки серной кислотой:
(R4N)2CО3 + 2 HSО4- = 2 (R4N)HSО4 + СО32-.
Окончание предыдущей технологической схемы при применении карбонатной регенерации анионита представлено на рисунке:
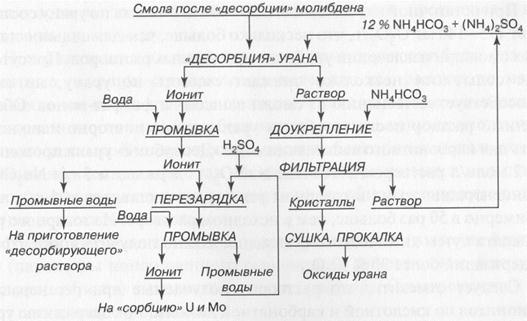
Технологическая схема карбонатной регенерации анионита.
Извлечение урана из карбонатных растворов с помощью анионообменных смол. После карбонатного выщелачивания уран находится в растворе в виде комплексного аниона [UO2(CO3)3]4-. Поскольку константа стойкости этого аниона 2-1018, т. е. на 15 порядков больше, чем константа стойкости сульфатных анионных комплексов, то нет смысла говорить о существовании подвижного равновесия между катионом UO22+и анионом [UO2(CO3)3]4-, катион UO22+практически отсутствует. Поэтому для извлечения урана из карбонатных растворов можно использовать только аниониты. Выбор анионитов ограничен в связи с тем, что среда - щелочная, можно использовать только сильноосновные аниониты, работающие при всех значениях рН.
В США использовали для извлечения урана из карбонатных растворов сильноосновный анионит IRA-400 (наш аналог этой смолы - AM).
В связи с большим зарядом карбонатного комплексного аниона процесс извлечения урана идет селективно:
4 R4NCl + [UO2(CO3)3]4- = (R4N)4[UO2(CO3)3] + 4Сl-.
Однозарядный анион алюмината практически не «сорбируется». При избытке соды практически не «сорбируются» ванадат-ион и фосфат-ион. Емкость смолы по урану падает с увеличением избыточной концентрации соды в исходном растворе, что объясняется конкуренцией карбонат-иона:
2 R4NC1 + СO32- = (R4N)2CO3 + 2Сl-.
Снижение емкости смолы IRA-400 (полная емкость 3,33 мг-экв/г) от повышения концентрации соды при исходной концентрации раствора 0,5 г/л по U3О8 проиллюстрировано ниже.
Концентрация Na2CO3, г/л 1 5 10 30 50 100
Емкость по урану, мг U3O8 г/л 274 200 191 163 130 100
При остаточной карбонатности 20-40 г/л емкость по урану составляет 175 - 140 мг U3О8/г, что несколько больше, чем для сильноосновных смол при извлечении урана из сернокислых растворов. Присутствие соды хотя несколько снижает емкость по урану, но зато способствует вытеснению из смолы ванадат- и фосфат-ионов. Обедненный раствор после «сорбции» урана можно повторно использовать для карбонатного выщелачивания. «Десорбция» урана проводится 2 моль/л раствором NaCl или NaNО3, содержащим 5 г/л Na2CО3. Концентрация урана в товарном регенерате составляет ~25 г/л, что примерно в 50 раз больше, чем в исходном растворе. Из товарного регенерата путем химического осаждения можно получить концентрат, содержащий более 90 % U3О8.
Следует отметить, что растворы, получаемые при регенерации анионитов по кислотной и карбонатной линиям, по содержанию урана и примесей близки. Тем самым нивелируется такое преимущество карбонатного выщелачивания, как его селективность. Поэтому кислотное выщелачивание имеет более широкое распространение, чем карбонатное. Кислотное выщелачивание применяется для вскрытия всех руд, за исключением высококарбонатных вследствие слишком большого расхода серной кислоты.
На большинстве американских и канадских заводов после карбонатного выщелачивания уран осаждали едким натром. Ионообменное извлечение урана из карбонатных растворов в контейнерных аппаратах использовалось на заводе «Монтиселло», остановленном в 1960 г., а также на заводе «Моаб» до 1975 г. В процессе реконструкции завода отказались от «сорбции» из карбонатных пульп и перешли на прямое осаждение урана сначала едким натром, а на втором этапе безводным аммиаком с добавлением пероксида водорода.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 7795; Нарушение авторских прав?; Мы поможем в написании вашей работы!