
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Краткая характеристика промышленных способов получения металла
|
|
|
|
Методы получения урана, применяемые в промышленных масштабах
1. Восстановление оксидов кальцием или магнием.
Из данных об изобарных потенциалах образования оксидов следует, что кальций способен энергично восстанавливать оксиды урана до металла.
UO2 + 2 Ca → 2 CaO + U Δ Нo298 = -46,8 ккал/г-атом
1/3 U3O8 + 8/3 Ca → 8/3 CaO + U Δ Нo298 = -122,8 ккал/г-атом
UO3 + 3 Ca → 3 CaO + U Δ Нo298 = -163,5 ккал/г-атом
Если сравнить теплоты реакций, то, исходя из более высоких Δ Н реакций восстановления UO3 и U3O8 можно ожидать и более высоких температур процесса, чем при восстановлении UO2.
Однако это тепло нельзя рационально использовать, т.к. его недостаточно для расплавления оксида кальция, а в условиях производства столь высокие температуры вызывают ненужные технологические затруднения. Кроме того, на восстановление одного и того же количества урана приходится затрачивать больше восстановителя, что удорожает процесс.
UO2 + 2 Ca + CaCl2 → U + 2 CaO(CaCl2) 900-1000 oC
Металлический кальций вводится в избытке (до 25% от стехиометрии), хлорид кальция, выполняющий роль флюса для понижения температуры плавления шлака, вводится в количестве ~10 масс.% от получающегося СаО. Масштабы производства урана данным способом составляют до 200 кг металла.
Следует помнить, что tпл.(СаО) = 2570 оС, tпл.(MgО) = 2640 оС
tкип.(Са) = 1487 оС, tкип.(Mg) = 1107 оС
Реакцию ведут в герметичных сосудах – «бомбах» из жаропрочных сплавов, со вставными стаканами из нержавеющей стали.
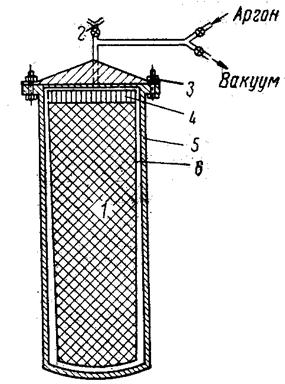
Схема реактора для восстановления небрикетированной шихты из диоксида урана и кальция.
1 – шихта Са + UO2, 2 – клапан для понижения давления, 3 – фланцевое уплотнение, 4 – графит, 5 – стенка реактора из нержавеющей стали, 6 – футеровка из окиси кальция.
Существенное значение при восстановлении двуокиси урана кальцием имеет подготовка исходных продуктов. Для восстановления применяют измельчённый дважды дистиллированный кальций. Хорошо смешанную шихту либо прессуют в брикеты, либо загружают свободной засыпкой. В последнем случае применяют аппарат из нержавеющей стали с футеровкой из окиси кальция. После загрузки шихты аппарат закрывают, вакуумируют и заполняют гелием или аргоном до давления 400-500 мм рт. ст. В процессе восстановления реактор нагревают до 1250-1300 оС в электрической печи. Реакция начинается при 700-800 оС. После начала реакции она быстро распространяется по всему объёму шихты. В реакционной зоне температура повышается значительно выше температуры плавления урана, поэтому первым продуктом восстановления являются мельчайшие капли жидкого урана, на поверхности которых имеется плёнка из окиси кальция, препятствующая их слиянию. Однако высокая температура и некоторая растворимость кальция в оксиде кальция делают эту плёнку полужидкой и близлежащие капли сливаются в частицы. Для полного восстановления продукты реакции выдерживают при 1200 оС не менее 30 мин. За это время происходит слиянию мелких капель урана в более крупные. Увеличение времени выдержки даёт более крупные частицы.
По окончании выдержки реактор выгружают из печи и охлаждают до комнатной температуры. Спек удаляют (футеровка при этом разрушается).
Плав «гасят» водой: CaO + H2O → Ca(OH)2 с добавками уксусной или азотной кислот. Чаще используют уксусную, т.к. ацетат кальция является буфером, поддерживающим рН около 5,8; при этих условиях уран не переходит в раствор.
Последовательная отмывка мелкокристаллического урана:
H2O → CH3COOH (уксусная к-та) + H2O → C2H5OH → (C2H5)2O.
Сушка осуществляется при низких температурах <30-40 оС. Лучше эту операцию проводить в инертной атмосфере. Также необходимо принимать во внимание пирофорность образующегося порошка металлического урана.
Извлечение урана в готовый продукт составляет от 70 до 97 %.
Содержание металлических примесей определяется чистотой шихты.
Металл получается «жёстким» (из-за наличия кислорода в металле и вторичного окисления урана при механической и водной обработке плава). Возможные пути усовершенствования метода заключаются в использовании шлаковых систем.
Таким образом можно получать и сплавы урана с другими металлами, например при восстановлении сложных оксидов типа UO3·MoO3, UO3·NiO или механических смесей оксидов.
Для магнийтермического восстановления используют аналогичную аппаратуру. Более низкая максимальная температура реакции и отсутствие растворимости магния в поверхностных плёнках оксида магния создают условия для образования очень мелкого и пирофорного порошка урана (борьба – применение флюса MgCl2). Оптимальный технологический режим – выдержка при 1200 оС в течение 1-2 ч.
2. Бесфлюсовое восстановление гидридом кальция.
Наряду с кальцием для восстановления оксидов урана может применяться и гидрид кальция. Первая программа по производству урана в США выполнялась путём восстановления двуокиси урана гидридом кальция.
U3O8 + 6 CaН2 → 3 U + 6 CaO + 2 Н2О + 4 Н2 940-960 oC
Гидрид кальция берётся с избытком около 25% от стехиометрически необходимого.
Непрерывное восстановление проводят во вращающихся трубчатых печах в атмосфере водорода. Прямое извлечение достигает 85% за счёт сохранения чистоты поверхности кальция и образующегося урана. Практические сложности процесса связаны с использованием водорода
Металл содержит несколько меньше (по сравнению с (1)) кислорода, поэтому более пластичен.
3. Электролиз с получением кристаллических осадков урана.
Обычно используют различные смеси галоидных солей урана с галогенидами щелочных или щелочноземельных металлов.
Например:
NaCl – KUF5 конц. U – 5-7 масс.%
NaCl – KCl – UCl4 t = 600-700 оС
NaCl – СаCl2 – UF4 t = 800-900 оС
Учитывая сравнительно высокую летучесть, гигроскопичность и сложность приготовления хлорида урана на практике предпочитают фторид урана. Однако при использовании UF4 и электролитов, содержащих ионы щелочноземельных металлов, труднее отмывать катодный продукт из-за низкой растворимости фторидов щелочноземельных металлов. Из-за этого на практике отдают предпочтение смесям фторида урана и хлоридов щелочных металлов.
iк = 0,5 – 1,5 А/см2. Регулируется плохо!
Ванны с гарнисажным покрытием.
Масштаб ванны: I = 1000-3000 А. Р = 30-100 кг/сутки.
Выход по току η = 60-70%
Один из предложенных электролитов NaCl-CaCl2-UF4 или K2UF6 (800-900 оС). В процессе длительного электролиза выход урана постепенно падает из-за увеличения вязкости расплава вследствие накопления фторида кальция. Наличие ионов калия способствует образованию пирофорных осадков, поэтому отдают предпочтение тетрафториду.
Катодный осадок – порошок урана содержит («захватил») от. 30 до 70% электролита. Для предотвращения возгорания извлечённый осадок погружают в измельчённую поваренную соль, находящуюся в сосуде, охлаждаемом водой. Осадок сбивают с катода, дробят и отмывают водой.
После отмывки кристаллов прямое извлечение 80-90%.
Найдены условия получения компактного металла – электрокристаллизация из расплавленных электролитов.
4. Получение урана электролизом в жидком состоянии.
Дендритные осадки, полученные электролитическим способом, содержат большое количество электролита, поэтому необходим ряд дополнительных операций для отделения урана от солей. Возможное решение проблемы – получение электролизом жидкого металла.
Электролиты – фториды щелочных и щелочноземельных металлов (LiF, NaF, BaF2, MgF2).
Например: электролит MgF2 – BaF2 – UF4 (мол.% 40 – 40 – 20). Вводится ещё и UO2 (растворимость в солевой ванне не превышает 2 масс.%). t ~ 1250 оС.
Катод – жидкий уран на особо чистом графите. ik = 1 – 1,5 А/см2.
UF62- + 4 e → U + 6 F-
Анод – графит. ia = 3 – 4 А/см2.
O2- + C – 2 e → CO
η ≈ 75%
Масштаб IΣ = 25 kА. Тогда Q = 25 х 24 = 600 кА/сутки.
Р = 600 х 2,22 х 0,75 ≈ 1000 кг/сутки.
Металл получается высокой чистоты (особенно по кислороду и азоту, кислород связывается в оксид углерода). Содержание кислорода в конечном металле ≈ 5 10-4 масс. %.
Процесс может быть непрерывным.
5. Восстановление UCl4 кальцием.
UСl4 + KCl + 2 Ca → U + 2 CaCl2(KCl)
Обычная рабочая температура для данного метода составляет 850-900 oC, при получении порошка урана она может быть снижена до 600-700 оС (температура плавления СаСl2 составляет 748 оС). ΔН реакции равно -165,9 ккал/г атом U.
Требуется строгая герметизация оборудования.
После реакции поднимают температуру до 1200-1250 оС, благодаря чему получают слиток урана в тиглях из СаО.
Извлечение очень высокое, > 99 %, иногда 99,8 %.
Универсальность метода заключается в возможности получать порошок, губку, слитки (небольшие).
Высокое извлечение и простота переработки легко растворимого в воде шлака позволяют использовать способ там, где потери урана недопустимы, например если речь идёт об U235 или U233. При получении обогащённого урана масштабы производства очень невелики – «кофейная чашечка» для U235-U238 и U233.
6. Получение чернового металла (восстановление тетрафторида).
UF4 + 2 Ca → U + 2 CaF2 tmax = 1800-2100 oC
ΔНo = -576 кДж/моль или -137,6 ккал/моль
Реакция восстановления UF4 кальцием протекает в довольно сложных условиях из-за присутствия небольших количеств влаги в тетрафториде урана, азота и кислорода в кальции и атмосфере реактора и других примесей.
Восстановление протекает в две стадии:
2 UF4 + Ca → 2 UF3 + CaF2
2 UF3 + 3 Ca → 2 U + 3 CaF2
Из-за наличия влаги в шихте и футеровке происходят следующие реакции:
UF4 + 2 H2O → UO2 + 4HF
UF4 + 2 H2O + 1/3 O2 → 1/3 U3O8 + 4 HF
При t > 900 oC возможно образование гесафторида урана:
2 UF4 + O2 → UF6 + UO2F2
Побочные реакции:
Ca + H2O → CaO + H2
2 Ca + O2 → 2 CaO
UF4 + 2 CaO → UO2 + 2 CaF2
UF4 + 2 H2O + Ca → UO2 + 2 CaF2 + 2 H2
Образующийся жидкий уран восстанавливает тетрафорид:
3 UF4 + U → 4 UF3
4 UF3 + 6 Ca → 4 U + 6 CaF2
Наличие азота в атмосфере реактора и кальции приводит к следующим реакциям:
3 Ca + N2 → Ca3N2
2 U + N2 → 2UN
Ca3N2 + 2 U → 2 UN + 3 Ca
В дальнейшем образуются оксикарбонитриды урана, концентрирующиеся в верхней части чернового слитка, что снижает выход урана в слиток.
Тетрафторид урана не должен содержать более 0,1% щелочных металлов, т.к. при восстановительной плавке они также восстанавливаются до металлов, давление пара которых при температуре реакции достигает десятков атмосфер. Из-за присутствия паров щелочных металлов происходит бурная плавка с плохим разделением продуктов, а иногда и с выбросом расплавленной массы.
В качестве восстановителя используют дистиллированный кальций. Плёнка оксида или нитрида на поверхности кальция препятствует контакту с тетрафторидом урана, это снижает скорость реакции.
Для возбуждения реакции восстановления используют электроэнергию или зажигают магниевую ленту с термитным запалом (магний + перекись натрия или нитрат калия + лактоза).
Ход процесса определяется расположением запала. При верхнем запале реакция протекает сверху вниз и образующиеся капли урана стекают через шихту, отдавая ей тепло. При этом также стекающий уран активно взаимодействует с атмосферой. При нижнем запале капли урана всё время остаются в горячей зоне, что способствует получению более нагретого металла и более полному отделению металла от шлака. От влияния атмосферы уран защищён жидким шлаком.
Точка кипения кальция (1487 оС) мало отличается от температуры плавления CaF2 (1418 оС) поэтому реакция проходит при практически атмосферном давлении. Реакторы не требуют особой герметичности.
Реакторы футеруют CaF2, CaO, MgO или графитом высокой чистоты.
Данный метод нашёл применение в разное время в Великобритании, Франции, Швеции и России. Восстановление магнием использовалось в США.
Рассмотрим организацию восстановительной плавки урана на примере российских предприятий.
Масштабы производства составляют до 15 т металла. Основным аппаратом является шахтная печь. Существуют шахтные печи различных типов, в зависимости от массы производимого за одну плавку металла:
ШП-1 → ШП-3 → ШП-7,5 → ШП-10 → ШП-15
Узловая проблема – конструкционные материалы шахты, и ещё острее изложницы и системы разливки металла.
Единственный материал шахты – это различные сорта плотного графита.
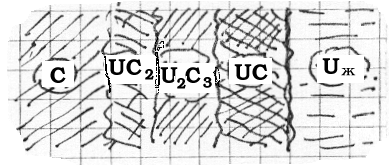
Столь же важна проблема теплового баланса плавки. Всё рассчитано на использование тепла реакции - QΣ.
QΣ = Qпол. + Qпотерь расс. + Qакк.
Чем больше масштабы плавки тем большая доля в балансе Qпол., т.е. теплосодержание продуктов реакции U(Ж.) и CaF2 (Ж.) и, следовательно, их более высокая температура. А чем выше перегрев, тем должно быть лучше разделение жидких фаз, металла и шлака.
Но! Чем выше температура, тем сильнее взаимодействие металла с графитом и науглероживание урана.
Время протекания реакции – 1-2 мин.
| тип ШП | развив. tmax, оС | время отстоя, мин. |
| ШП-1 | 20-25 | |
| ШП-3 | 35-40 | |
| ШП-7,5 | 50-60 |
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 551; Нарушение авторских прав?; Мы поможем в написании вашей работы!