
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электролитическая диссоциация воды. Ионное произведение воды. Показатель среды рН
|
|
|
|
|

Вода - очень слабый амфотерный электролит, при ее диссоциации образуется одинаковое число ионов Н+ и ОН-, согласно уравнению:
Н2О ⇄ Н+ + ОН - 
В соответствии с законом действующих масс, константа равновесия этого процесса равна:
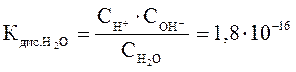 (при t = 250C) где
(при t = 250C) где 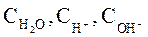 – равновесные концентрации ионов водорода, гидроксила и воды соответственно.
– равновесные концентрации ионов водорода, гидроксила и воды соответственно.
Если учесть, что 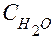 - количество молей воды в 1 л (1000 г) воды равно:
- количество молей воды в 1 л (1000 г) воды равно:
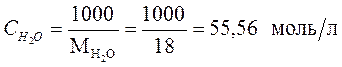 ,
,
где  = 18 г/моль – мольная масса воды, тогда произведение концентраций ионов воды равно:
= 18 г/моль – мольная масса воды, тогда произведение концентраций ионов воды равно:

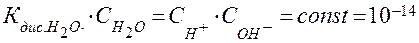 .
.
Это произведение называют ионным произведением воды и обозначают  .
.
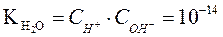 .
.
Следовательно, ионное произведение воды  – произведение концентраций ионов Н+ и ОН- - величина постоянная при постоянной температуре не только в чистой воде, но и в любом водном растворе электролита (сильного или слабого), в том числе содержащем кислоты, основания или соли, и при Т= 298К равна 10-14 .
– произведение концентраций ионов Н+ и ОН- - величина постоянная при постоянной температуре не только в чистой воде, но и в любом водном растворе электролита (сильного или слабого), в том числе содержащем кислоты, основания или соли, и при Т= 298К равна 10-14 .
Среда водных растворов. Водородный показатель pH
Из уравнения (26) следует, что при диссоциации молекул воды ионы H+ и OH- образуются в равных количествах, следовательно, в чистой воде при Т= 298К:
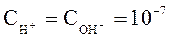 .
.
Растворы, в которых 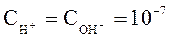 относят к нейтральным.
относят к нейтральным.
Носителями кислотных свойств являются ионы Н+, а носителями основных свойств – ионы ОН-. Поэтому растворы, в которых: 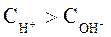 и
и 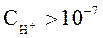 называют кислыми. Растворы, в которых:
называют кислыми. Растворы, в которых: 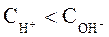 и
и 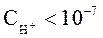 называют щелочными.
называют щелочными.
В практической работе неудобно производить расчеты с концентрациями, выраженными числами с отрицательными показателями степеней. Поэтому принято выражать концентрацию водородных ионов через водородный показатель pH – десятичный логарифм концентрации ионов Н+ , взятый с обратным знаком:
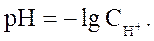
Так как в чистой воде концентрации Н+ и ОН- ионов равны, вода является нейтральной средой, которой соответствует рН = 7.
Добавление к воде кислоты увеличивает концентрацию ионов Н+, снижая рН. Следовательно, кислые растворы имеют рН < 7.
Добавление к воде ионов ОН- должно приводить к снижению концентрации ионов водорода, следовательно, все щелочные растворы имеют рН > 7.
В табл. отображены концентрации ионов Н+ и соответствующие значения рН для различных сред водных растворов.
Таблица 14
Концентрации ионов Н+ и значения рН в различных средах
водных растворов.
| Среда | СН+ | рН |
| Кислая | СН+ > СОН- СН+ > 10-7 | < 7 (6,5,4,…0) |
| Нейтральная | СН+ = СОН- = 10-7 | |
| Основная | СН+ < СОН- СН+ < 10-7 | >7 (8,9,10,…14) |
Для кислых, нейтральных и щелочных растворов можно построить единую шкалу рН. Область возможных значений рН: от рН=0 до рН=14.

|


 0 усиление кислотности среды 7 усиление щелочности среды 14
0 усиление кислотности среды 7 усиление щелочности среды 14
|
| |||||
| ||||||
Аналогично водородному иногда используют гидроксильный показатель среды - pОН; 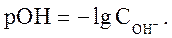
Поскольку 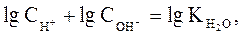
в любом водном растворе электролита (кислоты, основания, соли):  .
.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1281; Нарушение авторских прав?; Мы поможем в написании вашей работы!